• MC-F-001. Capítulo 1. El envejecimiento: definiciones y teorías.
1.1 ¿Qué es el envejecimiento?
Los individuos de la especie humana (Homo sapiens) al igual que los del resto de especies animales, estamos sometidos a un ciclo vital que comienza con la fecundación y finaliza con la muerte. Desde un punto de vista biomédico, el envejecimiento es la etapa final de dicho ciclo, que tras un periodo de tiempo variable, conduce a nuestra desaparición como seres vivos. El ciclo vital humano comprende una serie de fases o etapas que se han empleado para, en algunos casos de una forma arbitraria, poder dividir a conveniencia la longitud temporal de nuestra vida.
En una aproximación más concreta al proceso de envejecimiento podemos decir, y como iremos ampliando en esta obra, que el envejecimiento es una reducción concomitante con la edad, de las capacidades de los procesos fisiológicos que nos permiten mantener la correcta estructura y función de las diversas moléculas, orgánulos, células, tejidos, órganos y sistemas de nuestra economía, para adaptarnos a las variaciones del medio interno y externo. Pero esa concomitancia con el paso del tiempo no significa que el envejecimiento sólo deba ser estudiado en las etapas finales de nuestra vida, muy al contrario, debe ser analizado desde el mismo momento de la fecundación, pues ya en ella se determinan, hasta cierto punto, algunas de las características fundamentales de este proceso.
1.2 Etapas del ciclo vital
El ciclo vital lo consideramos dividido en varias etapas, algunas de ellas se encuentran bien definidas por sucesos biológicos concretos, mientras que otras son de aparición y duración variable. Siguiendo a Weinert y Timiras (2003) podemos establecer las siguientes fases del ciclo vital.
|
PERIODO |
DURACIÓN |
|
PRENATAL |
|
|
• Embrionario - Fecundación - Segmentación - Blastocisto - Organogénesis • Fetal |
Tiempo 0. 7 primeros días. Desde el día 8 hasta la implantación (día 14). Desde el día 14 al día 56. Desde la octava semana hasta el nacimiento. |
|
POSTNATAL |
|
|
• Nacimiento • Neonatal • Infancia • Adolescencia • Adulto • Envejecimiento • Muerte |
Día primero. Cuatro primeras semanas. Diversas etapas hasta los 14 años. Diversas etapas hasta los 18 años. Diversas etapas hasta los 65 años. Desde los 65 años (duración variable). |
Tabla 1. Etapas del ciclo vital. Presentamos un ciclo vital “ideal”, con una larga fase de envejecimiento sano, pero la etapa final de muerte puede ocurrir en cualquier momento de dicho ciclo (elaboración propia).
1.2.1 Etapa prenatal
La fase prenatal del ciclo vital comprende el periodo de tiempo que transcurre desde el momento de la fecundación hasta el nacimiento. Ya esta definición nos muestra, en condiciones normales, la dificultad de fijar el momento exacto de la fecundación, aunque parece más fácil establecer el momento del nacimiento. Asimismo, la duración del periodo prenatal es variable y se sugiere que dura unos 270 días tras la fecundación, aunque la realidad muestra que este periodo tiene desviaciones típicas importantes. La etapa prenatal se ha dividido en dos fases; el periodo embrionario y el fetal.
1.2.1.1 Periodo embrionario
Se extiende desde el momento de la fecundación hasta el día 56 de vida intrauterina y posee las siguientes fases:
- A) La fecundación: es la unión de los dos gametos (haploides); el ovocito y el espermatozoide para dar origen al zigoto (diploide). La fecundación suele tener lugar en el tercio externo del oviducto. Debemos recordar que tanto el ovocito que se libera en la ovulación, como el espermatozoide que lo fecunda, tienen su origen, respectivamente, en el ovario y el testículo, donde en su formación acontecen procesos madurativos importantes (ovogénesis y espermatogénesis) que ya determinan, hasta cierto punto, la base del envejecimiento.
- B) La segmentación: el zigoto comienza a migrar hacia el útero y al mismo tiempo va dividiéndose por mitosis y de esta manera amplia el número de células que lo forman, pero sin incrementar su tamaño inicial.
- C) El blastocisto: es el que se implanta en la cavidad uterina tras, como hemos comentado, unos 14 días postfecundación.
- D) La organogénesis: tras la implantación comienza el periodo en el cual se comienzan a formar los esbozos de los diferentes órganos y esta fase concluye al final de la octava semana, momento en el cual están ya presentes las estructuras primordiales de los órganos esenciales.
1.2.1.2 Periodo fetal
Esta etapa comprende el resto de la vida intrauterina y finaliza con el nacimiento. En ella se produce, fundamentalmente, la maduración de los órganos.
1.2.2 Etapa postnatal
La fase postnatal comprende la parte del ciclo vital desde el nacimiento hasta la muerte. Esta fase la podemos subdividir en diversas etapas.
1.2.2.1 Periodo neonatal
Desde el nacimiento hasta el final de la cuarta semana (28 días).
1.2.2.2 Infancia-niñez
(Hasta los 14 años). Es importante señalar que en los últimos años de la niñez aparecen importantes cambios morfo-fisiológicos (Adolescencia), que determinan el inicio del periodo reproductor.
1.2.2.3 La etapa adulta
Comienza a los 18 años, al menos de forma legal, y finaliza al cumplir los 65 años momento en el que, también de una forma jurídica, se ha establecido el comienzo de la vejez. Con cierta variabilidad temporal, al comienzo del último tercio de esta etapa de vida adulta, tiene lugar la aparición de la menopausia en las mujeres. Como veremos más adelante, tanto la duración como el final de la etapa fértil en las hembras de un gran número de especies animales tiene una gran importancia evolutiva en la determinación de la longevidad de las mismas.
1.2.2.4 Envejecimiento
Como ya hemos comentado comienza, de forma arbitraria, al cumplir los 65 años y su duración y características tienen una gran variabilidad. Para nosotros adquiere una relevancia fundamental esta etapa, por ser en ella cuando se presentan de una forma definitiva las consecuencias de los procesos que son objeto de este manual.
Un aspecto de capital importancia para abordar el estudio del envejecimiento es entender la paulatina transición que se produce entre la etapa adulta y la vejez. Aunque jurídicamente se considere este paso establecido al cumplir 65 años, es fácil de entender que desde un punto de vista biomédico este punto de corte basado en la cronología no tiene ninguna base científica. De esta manera ya establecemos una primera dicotomía entre la edad cronológica y la edad biológica. Mientras que la edad cronológica es fácil de determinar, la biológica es más difícil de establecer, al no poseer en la actualidad ningún marcador biológico específico que nos defina dicha edad. Esto nos introduce en la difícil definición de los valores de los diversos parámetros biomédicos utilizados para definir el envejecimiento. En medicina, la mayoría de los valores biomédicos que empleamos para definir los estándares de una población incluyen un amplio rango de edades y variables y se producen, en ocasiones, variaciones importantes sobre la media.
Al ser el envejecimiento la etapa final del ciclo vital y dada su variable duración, la caracterización de este proceso resulta, evidentemente, complicada. Así ya ha comenzado a subdividirse esta etapa en periodos más breves que ayudan a compartimentalizarla, según las diversas décadas de la vida, desde los 70 años: septuagenarios, octogenarios, nonagenarios, centenarios y supercentenarios (www.grg.org).
En el caso del reino animal en general y de los humanos en particular, muchos de los aspectos relacionados con la longevidad están de algún modo referidos a la reproducción de la especie concreta. Así, desde este punto de vista (reproductivo), el ciclo vital de una especie determinada posee tres etapas:
- Desarrollo.
- Reproducción.
- Envejecimiento-muerte.
Esta división, más simple del ciclo vital, tiene un eje fundamental centrado en los aspectos darwinianos del éxito de las especies basado en su capacidad reproductora. De hecho la mayoría de las especies tienen un periodo de envejecimiento muy corto tras finalizar su etapa reproductora. Cada una de estas tres fases tiene unas características específicas como son: El poseer una duración temporal variable, y la dinámica de su progreso es muy diferente, pues, cada una presenta diferentes mecanismos que la regulan y por último, las tres fases se suceden de forma progresiva, finalizando con la eliminación de cada individuo concreto de esa especie.
1.3 Carcterísticas del envejecimiento
El envejecimiento humano y el de los seres vivos con algunas variaciones puntuales en algunos casos, se caracteriza por los siguientes determinantes (Tabla 2).
|
ENVEJECIMIENTO |
ENFERMEDAD |
|
Universal |
Particular |
|
Progresivo |
Agudo-crónico |
|
Específico |
General |
|
Supresor |
Más o menos invalidante |
|
Incurable |
Tratable |
|
Irreversible |
Reversible |
Tabla 2. Se muestran las principales diferencias entre el envejecimiento y la enfermedad (elaboración propia).
1.3.1 Universal
El envejecimiento afecta a todos los seres vivos y constituye la etapa final de su ciclo vital. Como veremos en los capítulos siguientes, a lo largo de la escala filogenética, el envejecimiento es un proceso asociado y relacionado con el proceso de evolución de las especies. En general, cuanto más evolucionada es una especie, más prolonga su longevidad y, en consecuencia, el proceso de envejecimiento se muestra más florido.
1.3.2 Progresivo
Es un proceso en el cual es difícil determinar su punto de inicio, pero, una vez establecido ocurre de forma progresiva aunque su cinética es variable para capada especie y cada individuo concreto de cada especie. Así, veremos especies en las cuales el envejecimiento tiene lugar de forma rápida mientras que en otras, el envejecimiento ocupa un espacio temporal dilatado de la vida del animal.
1.3.3 Determinado-regulado
Con este bi-vocablo pretendemos señalar que existen dos aspectos fundamentales en el envejecimiento. En primer lugar, la base genética que determina gran parte de este proceso y por otro el efecto regulador que el ambiente puede ejercer sobre esta base genética. La información de los genes determina de una forma importante la habilidad de las células para combatir determinadas moléculas nocivas que se producen en su interior. Por otra parte, el ambiente entendido como nutrición, ejercicio, etc., sabemos que modula de una forma importante la expresión determinada genéticamente. En humanos, el estudio de los denominados síndromes progeroides (Síndromes de Werner y de Hutchinson-Gilford) que cursan con un envejecimiento acelerado ha aportado numerosos conocimientos al campo de la investigación del envejecimiento.
1.3.4 Supresor
Como consecuencia del envejecimiento se van perdiendo capacidades que, en última instancia, conducen a un fallo generalizado de la actividad. De forma concomitante al paso de los años, nuestros organismos acumulan alteraciones a nivel molecular, celular, tisular y sistémico que van dificultando la capacidad de adaptación a las variaciones del medio interno y externo (homeostasis-hormesis).
1.3.5 Irreversible
El envejecimiento no puede ser revertido a fases previas, aunque pueda, hasta cierto punto, ser ralentizado por la aplicación de diversas técnicas o terapias. En este sentido existen algunos comportamientos que parecen actuar de forma directa sobre un enlentecimiento de los procesos degenerativos asociados al envejecimiento. Entre los más destacados debemos señalar la restricción calórica, el ejercicio moderado y el consumo adecuado de diversas moléculas implicadas en la eliminación de catabolitos tóxicos que se producen como consecuencia del metabolismo celular.
1.3.6 Específico
Cada especie envejece de una forma diferente a las demás. Esto establece que el envejecimiento es específico de especie. Inclusive hay diferencias intraespecie (el envejecimiento humano no es igual en los países desarrollados que en los subdesarrollados). Esta característica hace que esta etapa del ciclo vital en humanos esté acompañada de las siguientes consecuencias:
- Un incremento de la mortalidad a medida que progresa la edad.
- Cambios bioquímicos en la composición de los tejidos del organismo.
- Progresiva reducción de la capacidad funcional de los órganos.
- Disminución de la capacidad de las respuestas de adaptación.
- Incremento de la susceptibilidad y vulnerabilidad a las enfermedades.
1.4 Envejecimiento frente a enfermedad
El envejecimiento per se no es una enfermedad, es un periodo del ciclo vital, aunque hay una cierta asociación entre este proceso y un incremento en la incidencia y severidad de las enfermedades. El envejecimiento humano se asocia, generalmente, a pluripatología entendida como la concomitancia de varios síndromes o enfermedades en una misma persona. De esta manera, es frecuente que el proceso de envejecer se vea afectado, y en algunos casos acelerado, por las patologías o enfermedades asociadas.
Las enfermedades, a diferencia del envejecimiento, (Tabla 2) no son universales, pues no afectan a todas las personas. Unas enfermedades pueden afectar a grupos diferentes y muchas de ellas nunca afectar a una persona o grupos de personas concretos. Las enfermedades pueden estar causadas tanto por factores genéticos como por la acción de factores ambientales. El proceso y los efectos de enfermar son variables, pero generalmente, tras cursar con un periodo variable de alteración orgánica, se resuelve con la recuperación de las funciones. Finalmente, podemos decir que en la actualidad poseemos aproximaciones terapéuticas para la mayoría de las enfermedades. Por estas razones debemos entender los procesos de enfermar y envejecer como diferentes aunque como ya hemos señalado, la aparición de determinadas enfermedades y alteraciones funcionales son más frecuentes en el envejecimiento.
1.5 Teorías del envejecimiento
Antes de abordar el estudio de las principales teorías que tratan de explicar el proceso de envejecimiento debemos indicar, siguiendo a K. R. Popper (1963), que la ciencia avanza cuando diversas teorías que tratan de explicar un determinado fenómeno confluyen para unificarse en una única que explica de forma satisfactoria el proceso que se estudia. En una exhaustiva revisión Mevdelev (1990) ha señalado que existen más de un centenar de teorías sobre el envejecimiento y, en la actualidad, ninguna explica con total satisfacción este proceso. Sin embargo tenemos que comentar que de entre todas las teorías que se han propuesto para explicarlo, hay dos que de forma más satisfactoria nos aproximan a su comprensión. Estas teorías son la del acortamiento de los telómeros y la de la acción de los radicales libres de oxígeno. Dada la importancia que estas dos aproximaciones están alcanzando, nos referiremos a ellas de manera específica en los capítulos siguientes. Pero no sería justo, ni siquiera apropiado, que nos olvidáramos de analizar otras teorías sobre el envejecimiento que explican, aunque de forma parcial, aspectos de este proceso.
El envejecimiento puede ser estudiado desde diferentes puntos de vista y como consecuencia de ello y dependiendo del enfoque empleado podemos clasificar las teorías del envejecimiento desde diferentes aproximaciones. En esta obra y atendiendo a la idea de que el envejecer debe ser analizado a todos los niveles de organización; desde el molecular al orgánico, desde los peldaños más inferiores de la escala evolutiva hasta los humanos, desde la persona a la sociedad, es decir un enfoque bio-psico-social, clasificaremos las teorías del envejecimiento en cuatro grandes grupos (Tabla 3). Además, como se podrá observar a lo largo de los apartados siguientes, existen grandes áreas de solapamiento entre las diversas aproximaciones y muchas de ellas representan aspectos concretos de un proceso más global. Pasaremos a continuación a analizar aquellas teorías más plausibles en la explicación del envejecimiento que pueden ser agrupadas en cuatro grandes grupos.
|
Teorías basadas en la evolución: – Acumulación de mutaciones. – Soma eliminable. – Antagonismo pleiotrópico. |
|
Teorías moleculares: – Regulación genética. – Restricción de codones. – Error-catástrofe. – Mutaciones somáticas. – Desdiferenciación. – Entrecruzamientos moleculares. |
|
Teorías celulares: – Acortamiento de telómeros. – Acción de radicales libres. – Apoptosis-necrosis. |
|
Teorías sistémicas: – Teoría neuroendocrina. – Teoría inmunológica. – Restricción calórica. |
Tabla 3. Teorías del envejecimiento.
1.5.1 Teorías basadas en la evolución
Las teorías basadas en la evolución de las especies consideran el envejecimiento como una respuesta adaptativa y programada genéticamente. La función del envejecimiento y la posterior muerte sería limitar el tamaño (en cuanto a número) de individuos de una especie y evitar de esta manera la sobreplobación. Pero dado que el envejecimiento no se observa en las poblaciones salvajes (Kirkwood, 2002) por el elevado índice de eliminación de sujetos por factores extrínsecos (accidentes, enfermedades, predadores, etc.), el envejecimiento no es necesario para prevenir la sobrepoblación. Asimismo se asume que, no sería necesaria la expresión de un gen que determinara el envejecimiento, pues como hemos comentado las especies (en su medio natural) no tendrían tiempo de envejecer. Como ejemplo podemos decir que los animales en su medio salvaje viven menos que los criados en cautividad. Del mismo modo los humanos de tribus primitivas viven menos que los de países desarrollados.
Si nuestro genoma o el de cualquier otra especie poseyera un gen específico que regulara el envejecimiento (a modo de reloj biológico determinante de la longevidad), sería posible que en algunos miembros de esa especie dicho gen hubiera mutado y en consecuencia hubiera permitido a los portadores de la mutación sobrevivir, mientras que los no portadores envejecerían y morirían. Esta mutación genética hubiera sido muy ventajosa y en consecuencia la selección para esta mutación sería elevada, conduciendo a la generación de individuos inmortales. Sin embargo, esto no ocurre y los miembros de las especies envejecen y mueren.
Como consecuencia de lo expuesto, las teorías basadas en la evolución se han refinado y sostienen que el envejecimiento es el resultado del declinar en la fuerza de la selección natural (ambiente) que permite a las especies envejecer al tener un ciclo vital más largo. Dado que la evolución tiene como objetivo prioritario, para la especie, maximizar la capacidad de reproducción, una vez pasada esta etapa reproductiva, comenzarán a manifestarse las características de envejecimiento que serán, como ya hemos comentado, diferentes en cada especie e individuo concreto. En esta línea de pensamiento han surgido tres variantes de la teoría basada en la evolución que tratan de explicar el envejecimiento.
1.5.1.1 Acumulación de mutaciones
Esta teoría fue propuesta por Medawar (1985) y propone que con el envejecimiento se van expresando genes que normalmente son silentes en etapas previas del ciclo vital. Esto determina que con el paso del tiempo se vayan acumulando sus productos, generalmente disfuncionales, que determinan la alteración de diversos sistemas orgánicos conduciendo al envejecimiento y finalmente a la eliminación de ese ser vivo. Así, si eliminamos en una especie experimental los efectos exógenos sobre ella (por ejemplo los depredadores) esta especie incrementará su longevidad, y es entonces, cuando aparece la manifestación de genes que pueden acumular alteraciones. Por ello, en humanos este efecto del incremento de la longevidad se ha visto asociado a la aparición de enfermedades degenerativas asociadas al envejecimiento que carecían de relevancia anteriormente.
1.5.1.2 Soma (cuerpo) eliminable
Esta teoría fue enunciada por Kirkwood (1984) y básicamente propone que a lo largo de la vida, las moléculas de las células están sometidas a numerosas alteraciones tanto internas (metabolismo, etc.) como externas (radiaciones, traumas, etc.). Estas alteraciones deben ser reparadas y para ello nuestras células poseen sistemas específicos de reparación de dichos daños, pero son energéticamente costosos de mantener. Esta teoría postula que el organismo prefiere dedicar sus limitados recursos más a la reproducción y por lo tanto a la proliferación de la especie que a los procesos de reparación de los daños celulares. La teoría predice que las especies que tienen numerosa descendencia, envejecen más rápido por la acumulación de daños somáticos y, en consecuencia, evolucionan hacia un ciclo vital más corto (menor periodo de envejecimiento).
En este sentido, estudios experimentales en moscas (Drosophila melonogaster) y en nematodos (Caenorhabditis elengans) han mostrado que si se eliminan ciertas células germinales, limitando así la reproducción, se incrementa la longevidad. Entre los mamíferos, el ratón (Mus musculus), que en estado salvaje mueren el 90% por diversas causas antes de cumplir los 10 meses, no dedica sus esfuerzos celulares a reparar sus sistemas lesionados más allá del tiempo en el cual el animal posee capacidad reproductora. Por el contrario, aquellas especies que tienen poca potencialidad reproductiva (v. gr. Homo sapiens) poseen mejores sistemas de reparación celular y “pagan” esta mejora con una disminución de su potencialidad proliferativa. Como corolario de lo antedicho se puede decir que aquellas especies que han mejorado sus sistemas de reparación de daños celulares vivirán más (mayor longevidad) que las que los tienen menos desarrollados.
1.5.1.3 Antagonismo pleiotrópico
Esta teoría fue propuesta por Williams (1957) y tiene su fundamento en el hecho de que un gen determinado, mediante la proteína que codifica, no sólo participa en una ruta o vía metabólica fundamental, sino que además puede participar de forma secundaria en otras. De esta manera un gen posee un efecto principal (fenotipo primario) y otras expresiones secundarias (pleiotropismo). En consecuencia, un gen que ha sido seleccionado evolutivamente por ofrecer ciertas ventajas en las etapas tempranas del ciclo vital, al actuar en etapas posteriores (etapa adulta) o durante más tiempo comenzaría a producir efectos deletéreos (antagonismo pleiotrópico).
En el caso del hombre, los andrógenos masculinos facilitan la maduración de las células germinales (espermatozoides), pero pasada la etapa de la vida adulta, estas hormonas pueden determinar la aparición de tumores hormono-dependientes como los relacionados con la próstata.
1.5.2 Teorías moleculares
Dentro de este grupo de teorías moleculares se agrupan aquellas que postulan que la longevidad de las especies está gobernada o regulada por genes que interactúan con factores ambientales. Del equilibrio en esta interacción dependerá la capacidad de una especie determinada de incrementar su longevidad por encima del periodo de reproducción.
Es sabido que la longevidad de las especies varía desde escasas horas o días en algunos invertebrados, un mes (mosca), un par de años (ratón), una década (perro), unos 40 años (gorila), y hasta unos 100 años (humanos). Esta característica, de determinación de la longevidad en cada especie, subyace en la base de las teorías moleculares. La figura 1 nos muestra un esquema de los posibles puntos de acción de las teorías moleculares.
1.5.2.1 Regulación genética
Del mismo modo que hay genes cuya expresión se produce de forma progresiva a lo largo del desarrollo y la fase de reproducción, esta teoría propone que el envejecimiento es el resultado de cambios en la expresión genética durante el envejecimiento (Von Hahn, 1966). Es decir, el envejecimiento estaría producido por la expresión de algún(os) gen(es) (gerontogen(es)) tras alcanzarse el final de la madurez en la reproducción. Parece evidente que numerosos genes muestran cambios en su expresión con la edad, pero parece poco probable que la selección pudiera actuar sobre genes que promueven el envejecimiento de modo directo. Más bien, la extensión del ciclo vital estaría influenciada por la selección de genes que promueven la longevidad.
Un ejemplo muy ilustrativo de la posible acción de algunos genes en la inducción del envejecimiento es el estudiado en el nematodo C. elegans. En este nematodo la mutación en un gen denominado age-1 incrementa la longevidad en aproximadamente un 75%. Se ha sugerido que este incremento está relacionado con la expresión de proteínas enzimáticas que actúan en los procesos de desactivación de determinadas moléculas tóxicas que se acumulan en las células con el envejecimiento (Johnson, 2003).
1.5.2.2 Restricción de codones
La información genética que contiene el ADN debe ser transcrita a una copia de ARN mensajero (ARNm) el cual lleva el mensaje para la síntesis de una proteína concreta. El mensaje del ARNm deber ser traducido por los ribosomas del citoplasma para que la proteína sea sintetizada. El mensaje en el ARNm viene codificado por los codones. Los codones son la sucesión de tres bases que contienen la información para la inserción de un determinado aminoácido para la síntesis de una proteína (Figura 1).
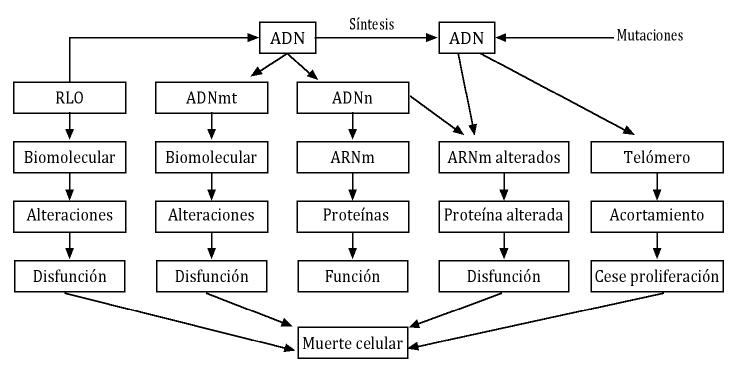
Figura 1. Diagrama en el que se muestran las principales rutas por las cuales se puede llegar a la muerte celular (elaboración propia).
Basándose en este principio, Strehler en 1971 propuso la teoría de la restricción de codones que señala que la fidelidad de la traducción del mensaje contenido en el ARNm se encuentra alterada en el envejecimiento. Esto origina que las proteínas que se sintetizan no sean funcionalmente activas o actúen de forma incorrecta, por lo cual se altera la funcionalidad de la célula y origina, en última instancia, su destrucción. Para la correcta traducción del mensaje del ARNm se necesitan diversas biomoléculas entre las cuales destaca el ARN de transferencia (ARNt) y la aminoacil-ARNt sintetasa. Las alteraciones en estas moléculas inducen errores en la traducción del mensaje del ARNm. En apoyo de esta teoría diversos estudios experimentales han puesto de manifiesto el incremento de estas alteraciones en especies tan diversas como la mosca, rata, conejo, etc.
1.5.2.3 Error-catástrofe
La teoría del error-catástrofe propone que los errores cometidos al azar en la síntesis de proteínas llevan con el tiempo a la alteración del propio ADN y otras biomoléculas (Orgel, 1963). Generalmente estos errores originan proteínas malfuncionantes que son eliminadas por la natural renovación de las mismas (turnover) y son sustituidas por otras que no contienen errores con lo cual su funcionalidad biológica está asegurada. Las moléculas alteradas y que están implicadas en la síntesis de otras moléculas introducen en las rutas del metabolismo celular nuevas moléculas alteradas. Esto va amplificando la acumulación de errores y conduce a un estado en la homeostasis celular que es incompatible con el mantenimiento de la vida funcional normal (catástrofe). Las alteraciones en las proteínas de las células y los tejidos envejecidos son, generalmente, debidas a errores post-transcripcionales tales como la oxidación y la glucosidación. El incremento en las células envejecidas del número de moléculas alteradas parece estar más relacionado con un defecto en la eliminación de las mismas que en su producción.
1.5.2.4 Mutuaciones somáticas
Esta teoría (Curtis, 1963) propone que el envejecimiento está causado por daños producidos al azar en el ADN. Estos daños se van acumulando con el paso del tiempo hasta que llegan a un umbral de daño a partir del cual se alteran las funciones celulares. En concreto esta teoría sostiene que son las mutaciones causadas por las radiaciones las que conducen al fallo funcional y finalmente a la muerte. La exposición a las radiaciones ionizantes (ver capítulo dedicado a la reparación del ADN) acorta la vida, sin embargo, los análisis de las curvas de supervivencia de poblaciones experimentales de ratones sometidos a radiaciones ionizantes revelaron un incremento en la mortalidad inicial sin un efecto marcado en el subsiguiente ritmo de envejecimiento. El acortamiento de la vida es probablemente debido al incremento en tumoraciones y otras enfermedades más que a una inducción de envejecimiento acelerado per se.
Un aspecto muy interesante a tener en cuenta es la capacidad que tienen las células para reparar su ADN. En este sentido las diferencias específicas en cada una de las especies respecto a la calidad de sus procesos de reparación de los daños causados sobre el ADN, pueden correlacionar con la longevidad de los diferentes animales. Por otra parte, la presencia de varias copias de un mismo mensaje genético (redundancia) pudiera ser un mecanismo de protección frente a la lesión de alguna copia (Cutler, 1973).
1.5.2.5 Desdiferenciación
Después de proponer el mecanismo de redundancia genética visto en el apartado anterior, Cutler (1982) refinó su aportación indicando que la acumulación de alteraciones en el genoma afecta la homeostasis celular desencadenando una cascada de reacciones dañinas que conduce a su muerte. Cutler llamó a este proceso desdiferenciación. Como se puede observar estas teorías moleculares tienen un fundamento común, algún tipo de modificación epigenética y del silenciamiento genético. En este sentido sabemos que la metilación (añadir un grupo metilo –CHO) de citosinas adyacentes a guaninas origina una inactivación de la expresión genética. Además estas metilaciones en el ADN se modifican con la edad. Estudios experimentales realizados en ratones han mostrado que la capacidad de desmetilación (proceso de eliminación de los grupos metilos para reparar el ADN) de dichas bases correlaciona con un incremento de la longevidad de las cepas de ratones en las que este proceso había sido inducido (Schmucker,1984 y Burzynski, 2003).
1.5.2.6 Entrecruzamientos moleculares (crosslinking)
Bjorksten, (1958), y posteriormente Cerami (1987) y Brownlee (1991) propusieron que el envejecimiento se produce como consecuencia de la formación de enlaces covalentes entre moléculas vecinas tanto intracelulares como extracelulares. Estos puentes moleculares impiden la normal actividad de las mismas originando, entre otras consecuencias, rigidez estructural, falta de adaptabilidad y finalmente pérdida de función. El colágeno, la proteína extracelular más abundante, es sintetizada por los fibroblastos y está formada por la agrupación regular de subunidades llamadas tropocolágeno. En animales jóvenes los puentes moleculares que se producen entre las fibrillas colágenas son eliminados por los sistemas de reparación de la matriz extracelular (metaloproteínas). Con el envejecimiento el colágeno incrementa su estabilidad térmica y su solubilidad disminuye, debido al aumento en los entrecruzamientos entre las cadenas de tropocolágeno.
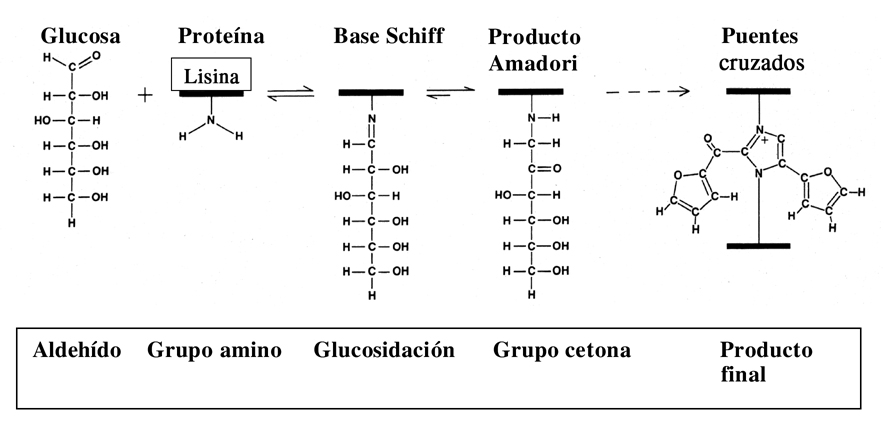
Figura 2. Formación de los puentes cruzados. Modificado de Cerami et al., 1995.
Otra molécula fundamental para el mantenimiento de nuestros sistemas energéticos es la glucosa. La unión no-enzimática de la glucosa a la cadena peptídica la inactiva y esta no cumple sus funciones fisiológicas. La mayoría de estos puentes intermoleculares que se producen entre la glucosa y las proteínas o el ADN son glucosilaciones (reacción Maillard). Dicha reacción comienza con la unión de un grupo aldehído de la glucosa con el grupo amino de la lisina de la proteína, y se forma una base de Schiff. Esta unión es inestable y se transforma en los productos Amadori (cetonas) que con el tiempo se deshidratan y reorganizan de forma irreversible en productos insolubles llamados productos finales de glucosidación (Advanced Glycation End-products –AGE–) que continúan uniéndose a otras proteínas vecinas e incluso al ADN. La paulatina extensión de este entramado de puentes intermoleculares cursaría entre otras con un incremento de la rigidez celular y la pérdida de elasticidad característica de los tejidos envejecidos. La formación de cataratas asociadas al envejecimiento es una forma de manifestar la presencia de estos productos.
1.5.3 Teorías celulares
Las teorías celulares del envejecimiento forman un grupo de aportaciones al conocimiento de este proceso que basan sus postulados en la acción de determinados procesos sobre la funcionalidad celular, fundamentalmente aquellos destinados a mantener su capacidad proliferativa y defensa ante la acción de las moléculas generadas por la vía aerobia de obtención de energía. Las teorías más caracterizadas y plausibles en este apartado son:
- Teoría del acortamiento de los telómeros.
- Acción de los radicales libres.
- Apoptosis-necrosis.
1.5.3.1 Acortamiento de telómeros (Senescencia celular)
Los telómeros constituyen las porciones más distales de los cromosomas y parece que una de sus funciones es la estabilización de la información genética. A medida que las células se dividen, los telómeros se acortan. Se ha sugerido (Harley 1990), que llegado un acortamiento límite en la longitud del telómero, la célula es eliminada, como mecanismo de protección de la integridad del genoma. El descubrimiento de la presencia de una enzima (telomerasa) que recupera la longitud del telómero en las células germinales y neoplásicas ha representado un importante avance en el estudio del envejecimiento, al menos de las células que poseen capacidad proliferativa.
1.5.3.2 Radicales libres
Harman (1956) propuso que la mayoría de los cambios asociados a la alteración de las moléculas se debían a la acción de radicales libres. Estos radicales son átomos o moléculas muy inestables por contener un electrón no apareado en su orbital más externo, por consiguiente, son muy reactivos. Los radicales libres más frecuentes en nuestras células son los producidos por el oxígeno (radicales libres de oxígeno). En las células eucariotas son las mitocondrias los organoides que producen estas moléculas, fundamentalmente, en la cadena de transporte de electrones. La acción de estos radicales explica muchas de las alteraciones que se producen en las células, tanto con capacidad proliferativa o quiescentes (postmitóticas y fijas en fase G0).
1.5.3.3 Apoptosis-Necrosis
Hay dos formas o patrones por los cuales las células mueren: la necrosis y la apoptosis. La necrosis es un proceso consecuencia de una acción accidental (traumatismos, etc.) sobre la célula, y se acompaña, generalmente, de inflamación en los tejidos afectados. Como consecuencia de esta lesión, la cromatina se condensa en masas de heterocromatina, los organoides celulares se dilatan y finalmente la célula se destruye por desintegración de la membrana celular.
En la apoptosis, el proceso de muerte de la célula es dirigido por genes específicos que inducen el suicidio celular en respuesta a un estímulo interno o externo, generalmente en ausencia de una lesión externa (Lockshin, 1990). La apoptosis implica la compactación y posterior segregación de la cromatina y la condensación del citoplasma. Posteriormente tanto el núcleo como el citoplasma se fragmentan y forman diversas masas esféricas, rodeadas de membrana citoplasmática que se denominan cuerpos apoptóticos que son, posteriormente, fagocitados por los macrófagos. Aunque los términos apoptosis y muerte celular programada suelen emplearse como sinónimos no definen el mismo proceso. La muerte celular programada es un evento del desarrollo, mientras que la apoptosis es un tipo de muerte celular (Lockshin, 2004). Gran parte de los conocimientos sobre las bases genéticas de la apoptosis se han conocido en C. elegans, donde se sabe que de las 1090 células que lo forman 131 mueren indefectiblemente (Horvitz, 1988).
1.5.4 Teorías sistémicas
Según estas teorías el envejecimiento está relacionado con el declinar en las funciones de diversos órganos esenciales para el control y mantenimiento de otros órganos o sistemas. Los sistemas nervioso, endocrino e inmune regulan y controlan las funciones de otros sistemas así como las respuestas a los estímulos internos y externos que se producen en nuestros organismos. Las teorías sistémicas son las siguientes:
- Teoría neuroendocrina.
- Teoría inmunológica.
- Teoría de la restricción calórica.
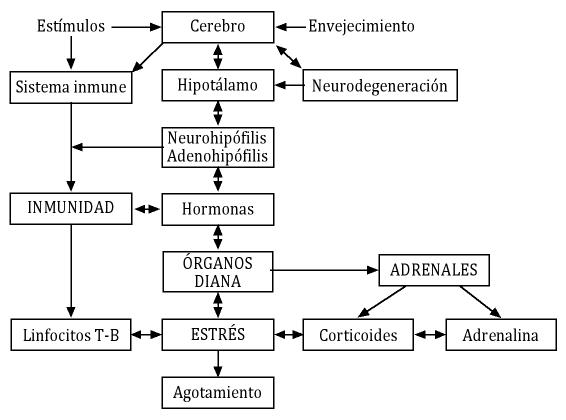
Figura 3. Esquema en el que se muestran las relaciones entre las teorías sistemáticas del envejecimiento (elaboración propia).
1.5.4.1 Teoría Neuroendocrina
Esta teoría propone que la disminución funcional, de las neuronas del sistema neuroendocrino y las hormonas que ellas producen (vasopresina, CRF, etc.) son las causas centrales del proceso de envejecimiento (para revisión ver Meites, 1992). El sistema neuroendocrino coordina las aferencias de los estímulos tanto internos como del medio externo. Respecto del medio interno, programa las respuestas homeostáticas y mantiene, entre otras funciones, los niveles hormonales necesarios para mantener el crecimiento (GH) y la reproducción (formación de gametos). La integración hipotalámica de las respuestas al entorno (medio externo) es llevada a cabo a partir de información que le llega de varias estructuras cerebrales (córtex, sistema límbico y formación reticular). El eje neuroendocrino regula muchos aspectos de la fisiología y las alteraciones en este sistema producirán importantes cambios funcionales en el organismo. El declinar en las funciones reproductivas femeninas con la llegada de la menopausia es un cambio evidente en este eje.
Una función del sistema endocrino es producir los ajustes necesarios para el mantenimiento de la homeostasis en respuesta a los cambios en el ambiente por medio de la liberación de hormonas suprarrenales (adrenales). Una de las respuestas más alteradas con el envejecimiento es la relacionada con las acciones del eje hipotálamo-hipófisis-suprarrenales. La médula de las glándulas suprarrenales sintetiza las catecolaminas adrenalina y noradrenalina cuya función, entre otras, es actuar como neurotransmisores de la división simpática del sistema nervioso autónomo. Estas hormonas responden al estrés incrementando la presión sanguínea y el metabolismo (catabolismo) facilitando la utilización de los hidratos de carbono (glucosa, glucógeno) y de lípidos para adaptarse a los incrementos energéticos. En este sentido, la exposición crónica al estrés severo por estímulos (físicos, biológicos o emocionales) puede conducir a las llamadas enfermedades de adaptación y a la muerte por agotamiento de estos sistemas (Valenti, 2004). Con el envejecimiento se reducen los niveles de estas hormonas y de manera concomitante, disminuyen también las denominadas proteínas intracelulares de respuesta dependientes del estrés (heat shock proteins –hsp–) lo cual incrementa la susceptibilidad al estrés.
Las hormonas de la corteza suprarrenal son glucocorticoides que regulan el metabolismo de los principios inmediatos y mineralocorticoides para regular el del agua, electrolitos y algunas hormonas sexuales. Entre las hormonas, la dehidroepiandrosterona (DHEA), es el metabolito inicial para la formación de las diversas hormonas sexuales, y sus niveles plamáticos disminuyen con la edad. Basados en esto, algunos investigadores la han empleado como sustituto terapéutico para paliar los efectos de la reducción de estas hormonas con la edad.
Diversos experimentos han mostrado que algunas alteraciones neuro-endocrinas pudieran estar relacionadas con el proceso de envejecimiento. Así, la hipofisectomía seguida del tratamiento hormonal sustitutivo mantiene la longevidad en roedores, frente a animales sólo hipofisectomizados. La teoría neuroendocrina del envejecimiento ha recibido un espaldarazo, experimental, con descubrimiento de una vía metabólica en el nematodo C. elegans que controla el estrés celular y la longevidad. Las mutaciones en algunos de genes de esta vía confieren a C. elegans resistencia al estrés ambiental, aumentan la resistencia a la privación de alimento e incrementan la longevidad. Además se ha visto que algunos de estos genes están conservados en mamíferos, desde ratones a humanos.
El factor-I de crecimiento tipo insulina (IGF-I) es un péptido homólogo a la insulina humana y el receptor IGF-I a su receptor en humanos. En C. elegans estos genes forman un sistema neuroendocrino muy primitivo en el cual el péptido IGF-I juega un papel importante en la regulación del metabolismo y la respuesta apropiada a los suministros de energía. En consecuencia se debe asumir que este sistema neuroendocrino primitivo tiene la capacidad no sólo de coordinar lo que ocurre en cada célula y tejido del organismo, sino que también evita la acumulación de moléculas tóxicas en respuesta al estrés. En este mismo sentido, estudios en ratones que expresan niveles menores de estos receptores han mostrado un incremento notable en su longevidad (Brown-Borg, 2003), sugiriendo que esta vía pudiera jugar algún papel en el alargamiento del ciclo vital.
Como veremos más adelante, asociado al envejecimiento cerebral humano se encuentra la aparición de las denominadas enfermedades neurodegenerativas, entre las cuales destacaremos las enfermedades de Alzheimer (EA) y Parkinson (EP). Estas neuropatologías cursan con diversas alteraciones en la síntesis de neurotransmisores (acetilcolina y dopamina), debido, fundamentalmente a la pérdida de las neuronas que los sintetizan.
1.5.4.2 Teoría Inmunológica
El sistema inmune, como sabemos, tiene importantes funciones en los organismos complejos y en concreto en humanos. Controla la composición molecular del organismo y también debe eliminar los organismos extraños que puedan penetrar y amenazar su integridad. En la mayoría de las personas mayores la inmunosenescencia está caracterizada por la disminución de la resistencia a las enfermedades infecciosas y una reducción en la protección contra el cáncer (Ram, 1967).
En humanos el timo sufre una involución y deja de producir células T y hormonas tímicas. El timo incrementa su tamaño y funcionalidad hasta la pubertad, después se atrofia (involución etaria) y es sustituido por tejido adiposo. Esta involución puede ser entendida como un proceso evolutivo en el cual tras sembrar de células T los órganos linfoides secundarios (ganglios, bazo, etc.) sería costoso mantener un órgano cuya función sería redundante. Además la coincidencia de la involución del timo con el incremento de las hormonas sexuales parece sugerir que pudiera existir una regulación inversa en este proceso. Finalmente debemos señalar que una característica de las personas centenarias es lo extraordinariamente bien preservada que tienen su inmunidad tanto en lo que se refiere a las características y proporciones de sus células T, células dendríticas, macrófagos y células B como del sistema complemento (Franceschi C y Bonafe M., 2003).
Ambas teorías (neuroendocrina y neuroinmune) se pueden fusionar en una más amplia que es la teoría inmuno-neuroendocrina del envejecimiento (Nandy, 1982). Se sabe que ambos sistemas están interconectados por moléculas tanto péptidos hormonales como citoquinas. Así, la interleukina-1 (IL-1) activa el eje neuroendocrino, estimulando la secreción de hormonas suprarrenales y puede también actuar en la liberación de otras hormonas (TSH, prolactina y LH). Además, tanto el sistema inmune como el neuroendocrino tienen gran plasticidad, es decir, gran habilidad para modificar sus funciones según la demanda. Aunque la plasticidad es más manifiesta en las etapas más tempranas del ciclo vital, se mantiene hasta ciertos niveles durante el envejecimiento. La sensibilidad a la insulina por los tejidos periféricos disminuye con la edad pero puede ser mejorada por la restricción calórica. Este aspecto nos enlaza con la siguiente teoría sistémica del envejecimiento, que basa sus supuestos en la reducción del metabolismo energético celular.
1.5.4.3 Restricción calórica y metabolismo
En la actualidad la variable más aceptada capaz de extender la vida en una gran diversidad de especies animales (gusanos, ratas, y monos) es la restricción calórica. Esta aproximación se consigue suministrando una dieta que contenga todos los nutrientes esenciales reduciendo su aporte en un rango del 30 al 70% de las calorías normalmente ingeridas cada día (Fernandes, 1976). Con esta aproximación experimental se ha visto que se puede incrementar significativamente la longevidad en numerosas especies. Además la restricción no sólo incrementa la longevidad, sino que mejora diversas actividades metabólicas (glucemia), inmunes (mejora las defensas frente al estrés, las infecciones y el cáncer) y neuroendocrinas (reestablece los niveles normales de diversas hormonas). Estos cambios pueden estar asociados a variaciones en la expresión de determinados genes (Anson, 2004).
La restricción calórica puede actuar promoviendo la longevidad por un mecanismo de reprogramación con un cambio transcripcional (pudiera aquí jugar algún papel la insulina) reduciendo el metabolismo energético e incrementando la biosíntesis y el recambio de proteínas. También se ha sugerido que al disminuir el aporte calórico se produce una reducción en la formación de radicales libres que pudiera estar en la base del incremento de la longevidad. Finalmente, comentaremos que la restricción calórica en humanos y animales jóvenes conduce a disminución de la talla, retardo en el inicio de la maduración sexual y una posible reducción en los niveles de inteligencia.
1.5.4.1 Teoría Neuroendocrina
Esta teoría propone que la disminución funcional, de las neuronas del sistema neuroendocrino y las hormonas que ellas producen (vasopresina, CRF, etc.) son las causas centrales del proceso de envejecimiento (para revisión ver Meites, 1992). El sistema neuroendocrino coordina las aferencias de los estímulos tanto internos como del medio externo. Respecto del medio interno, programa las respuestas homeostáticas y mantiene, entre otras funciones, los niveles hormonales necesarios para mantener el crecimiento (GH) y la reproducción (formación de gametos). La integración hipotalámica de las respuestas al entorno (medio externo) es llevada a cabo a partir de información que le llega de varias estructuras cerebrales (córtex, sistema límbico y formación reticular). El eje neuroendocrino regula muchos aspectos de la fisiología y las alteraciones en este sistema producirán importantes cambios funcionales en el organismo. El declinar en las funciones reproductivas femeninas con la llegada de la menopausia es un cambio evidente en este eje.
Una función del sistema endocrino es producir los ajustes necesarios para el mantenimiento de la homeostasis en respuesta a los cambios en el ambiente por medio de la liberación de hormonas suprarrenales (adrenales). Una de las respuestas más alteradas con el envejecimiento es la relacionada con las acciones del eje hipotálamo-hipófisis-suprarrenales. La médula de las glándulas suprarrenales sintetiza las catecolaminas adrenalina y noradrenalina cuya función, entre otras, es actuar como neurotransmisores de la división simpática del sistema nervioso autónomo. Estas hormonas responden al estrés incrementando la presión sanguínea y el metabolismo (catabolismo) facilitando la utilización de los hidratos de carbono (glucosa, glucógeno) y de lípidos para adaptarse a los incrementos energéticos. En este sentido, la exposición crónica al estrés severo por estímulos (físicos, biológicos o emocionales) puede conducir a las llamadas enfermedades de adaptación y a la muerte por agotamiento de estos sistemas (Valenti, 2004). Con el envejecimiento se reducen los niveles de estas hormonas y de manera concomitante, disminuyen también las denominadas proteínas intracelulares de respuesta dependientes del estrés (heat shock proteins –hsp–) lo cual incrementa la susceptibilidad al estrés.
Las hormonas de la corteza suprarrenal son glucocorticoides que regulan el metabolismo de los principios inmediatos y mineralocorticoides para regular el del agua, electrolitos y algunas hormonas sexuales. Entre las hormonas, la dehidroepiandrosterona (DHEA), es el metabolito inicial para la formación de las diversas hormonas sexuales, y sus niveles plamáticos disminuyen con la edad. Basados en esto, algunos investigadores la han empleado como sustituto terapéutico para paliar los efectos de la reducción de estas hormonas con la edad.
Diversos experimentos han mostrado que algunas alteraciones neuro-endocrinas pudieran estar relacionadas con el proceso de envejecimiento. Así, la hipofisectomía seguida del tratamiento hormonal sustitutivo mantiene la longevidad en roedores, frente a animales sólo hipofisectomizados. La teoría neuroendocrina del envejecimiento ha recibido un espaldarazo, experimental, con descubrimiento de una vía metabólica en el nematodo C. elegans que controla el estrés celular y la longevidad. Las mutaciones en algunos de genes de esta vía confieren a C. elegans resistencia al estrés ambiental, aumentan la resistencia a la privación de alimento e incrementan la longevidad. Además se ha visto que algunos de estos genes están conservados en mamíferos, desde ratones a humanos.
El factor-I de crecimiento tipo insulina (IGF-I) es un péptido homólogo a la insulina humana y el receptor IGF-I a su receptor en humanos. En C. elegans estos genes forman un sistema neuroendocrino muy primitivo en el cual el péptido IGF-I juega un papel importante en la regulación del metabolismo y la respuesta apropiada a los suministros de energía. En consecuencia se debe asumir que este sistema neuroendocrino primitivo tiene la capacidad no sólo de coordinar lo que ocurre en cada célula y tejido del organismo, sino que también evita la acumulación de moléculas tóxicas en respuesta al estrés. En este mismo sentido, estudios en ratones que expresan niveles menores de estos receptores han mostrado un incremento notable en su longevidad (Brown-Borg, 2003), sugiriendo que esta vía pudiera jugar algún papel en el alargamiento del ciclo vital.
Como veremos más adelante, asociado al envejecimiento cerebral humano se encuentra la aparición de las denominadas enfermedades neurodegenerativas, entre las cuales destacaremos las enfermedades de Alzheimer (EA) y Parkinson (EP). Estas neuropatologías cursan con diversas alteraciones en la síntesis de neurotransmisores (acetilcolina y dopamina), debido, fundamentalmente a la pérdida de las neuronas que los sintetizan.
1.5.4.2 Teoría Inmunológica
El sistema inmune, como sabemos, tiene importantes funciones en los organismos complejos y en concreto en humanos. Controla la composición molecular del organismo y también debe eliminar los organismos extraños que puedan penetrar y amenazar su integridad. En la mayoría de las personas mayores la inmunosenescencia está caracterizada por la disminución de la resistencia a las enfermedades infecciosas y una reducción en la protección contra el cáncer (Ram, 1967).
En humanos el timo sufre una involución y deja de producir células T y hormonas tímicas. El timo incrementa su tamaño y funcionalidad hasta la pubertad, después se atrofia (involución etaria) y es sustituido por tejido adiposo. Esta involución puede ser entendida como un proceso evolutivo en el cual tras sembrar de células T los órganos linfoides secundarios (ganglios, bazo, etc.) sería costoso mantener un órgano cuya función sería redundante. Además la coincidencia de la involución del timo con el incremento de las hormonas sexuales parece sugerir que pudiera existir una regulación inversa en este proceso. Finalmente debemos señalar que una característica de las personas centenarias es lo extraordinariamente bien preservada que tienen su inmunidad tanto en lo que se refiere a las características y proporciones de sus células T, células dendríticas, macrófagos y células B como del sistema complemento (Franceschi C y Bonafe M., 2003).
Ambas teorías (neuroendocrina y neuroinmune) se pueden fusionar en una más amplia que es la teoría inmuno-neuroendocrina del envejecimiento (Nandy, 1982). Se sabe que ambos sistemas están interconectados por moléculas tanto péptidos hormonales como citoquinas. Así, la interleukina-1 (IL-1) activa el eje neuroendocrino, estimulando la secreción de hormonas suprarrenales y puede también actuar en la liberación de otras hormonas (TSH, prolactina y LH). Además, tanto el sistema inmune como el neuroendocrino tienen gran plasticidad, es decir, gran habilidad para modificar sus funciones según la demanda. Aunque la plasticidad es más manifiesta en las etapas más tempranas del ciclo vital, se mantiene hasta ciertos niveles durante el envejecimiento. La sensibilidad a la insulina por los tejidos periféricos disminuye con la edad pero puede ser mejorada por la restricción calórica. Este aspecto nos enlaza con la siguiente teoría sistémica del envejecimiento, que basa sus supuestos en la reducción del metabolismo energético celular.
1.5.4.3 Restricción calórica y metabolismo
En la actualidad la variable más aceptada capaz de extender la vida en una gran diversidad de especies animales (gusanos, ratas, y monos) es la restricción calórica. Esta aproximación se consigue suministrando una dieta que contenga todos los nutrientes esenciales reduciendo su aporte en un rango del 30 al 70% de las calorías normalmente ingeridas cada día (Fernandes, 1976). Con esta aproximación experimental se ha visto que se puede incrementar significativamente la longevidad en numerosas especies. Además la restricción no sólo incrementa la longevidad, sino que mejora diversas actividades metabólicas (glucemia), inmunes (mejora las defensas frente al estrés, las infecciones y el cáncer) y neuroendocrinas (reestablece los niveles normales de diversas hormonas). Estos cambios pueden estar asociados a variaciones en la expresión de determinados genes (Anson, 2004).
La restricción calórica puede actuar promoviendo la longevidad por un mecanismo de reprogramación con un cambio transcripcional (pudiera aquí jugar algún papel la insulina) reduciendo el metabolismo energético e incrementando la biosíntesis y el recambio de proteínas. También se ha sugerido que al disminuir el aporte calórico se produce una reducción en la formación de radicales libres que pudiera estar en la base del incremento de la longevidad. Finalmente, comentaremos que la restricción calórica en humanos y animales jóvenes conduce a disminución de la talla, retardo en el inicio de la maduración sexual y una posible reducción en los niveles de inteligencia.
1.6 ¿Para cuándo una teoría unificada del envejecimiento?
Ninguna de las teorías sobre el envejecimiento que hemos comentado y otras que se escapan del análisis científico explican totalmente este proceso. Si bien es mucho el conocimiento que se está aportando en los últimos años al conocimiento del envejecimiento, aún creemos que explicar éste de una forma definitiva y por la implicación de un fenómeno único y universal llevará, si algún día se consigue, más tiempo del esperado. Sería definitivo el encontrar un único gen que actuara como “reloj” determinante de nuestro ritmo de envejecimiento. Actuar sobre él sería una aproximación interesante para retrasar su avance para modificar las consecuencias de su expresión y función. Antes de que esto ocurra, si llega a suceder, la ciencia debe ir aportando nuevos conocimientos sobre este apasionante tema.
En la actualidad se ha producido una nueva conceptualización en la aproximación al estudio del envejecimiento. Así, ya no se plantea el envejecimiento como una fase del ciclo vital caracterizado por la desestructuración (degeneración), el enfermar y el declinar en las funciones fisiológicas alcanzadas en etapas precedentes, fundamentalmente la etapa joven-adulta. Debemos prestar particular atención no sólo a los procesos generales, sino al particular envejecer de cada persona para entender la gran diversidad y heterogeneidad de este proceso. Además se debe hacer mención a la capacidad de poder predecir y curar muchas de las enfermedades y alteraciones que se asocian al envejecimiento.
El envejecimiento humano, desde esta perspectiva, lo podemos graduar en diferentes formas atendiendo al binomio envejecimiento-salud. Dicho rango se extiende desde una persona mayor sana a una persona impedida. Esto nos permite afrontar tres formas de introducirnos en el envejecimiento:
- Un envejecimiento saludable, con ausencia de alteraciones incapacitantes.
- Un envejecimiento, más frecuente, asociado a pequeñas patologías no invalidantes.
- Un envejecimiento asociado a enfermedad e invalidez con necesidad de ayuda para las tareas de la vida diaria. Estos aspectos serán objeto detallado de análisis en los capítulos de esta obra dedicados específicamente al envejecimiento humano.
Referencias
- Anson R. M. Absolute versus relative caloric intake: clues to the mechanism of calorie/aging-rate interactions. Ann. N Y Acad. Sci. 2004;1019:427-429.
- Bjorksten J. Cross linkages in protein chemistry. Adv Protein Chem. 1951;6:343-381.
- Bjorksten J. A common molecular basis for the aging syndrome. J. Am. Geriatr. Soc. 1958;8:740-748.
- Brownlee M. Glycosylation products as toxic mediators of diabetic complications. Annu. Rev. Med. 1991;42:159-166.
- Burzynski S. R. Gene silencing–a new theory of aging. Med. Hypotheses. 2003;60:578-583.
- Cerami A, Vlassara H., Brownlee M. Glucose and aging. Sci. Am. 1987;256:90-96.
- Curtis H., Crowley C. Chromosome aberrations in liver cells in relation to the somatic mutation theory of aging. Radiat Res. 1963;19:337-344.
- Cutler R. G. Redundancy of information content in the genome of mammalian species as a protective mechanism determining aging rate. Mech. Ageing Dev. 1973;2:381-408.
- Cutler R. G. The dysdifferentiation hypothesis of mammalian aging and longevity, in The Aging Brain: Cellular and Molecular Mechanisms of Aging in the Nervous System. Giacobibi, E. et al. (Eds). Raven Press. New York,1982.
- Fernandes G., Yunis E. J., Good R. A. Influence of diet on survival of mice. Proc. Natl. Acad. Sci. U S A. 1976;73:1279-1283.
- Franceschi C., Bonafe M. Centenarians as a model for healthy aging. Biochem. Soc. Trans. 2003;31:457-461.
- Harley C. B., Futcher AB., Greider C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 1990;345:458-460.
- Harman D. Aging: a theory based on free radical and radiation chemistry. J Gerontol. 1956;11:298-300.
- Hayflick L. Current theories of biological aging. Fed. Proc. 1975;34:9-13.
- Horvitz H. R. Genetic control of Caenorhabditis elegans cell lineage. Harvey Lect. 1988-89;84:65-77.
- Johnson T. E. Advantages and disadvantages of Caenorhabditis elegans for aging research. Exp. Gerontol. 2003;38:1329-1332.
- Kirkwood T. B. Towards a unified theory of cellular ageing. Monogr. Dev. Biol. 1984;17:9-20.
- Kirkwood T. B. Evolution of ageing. Mech. Ageing Dev. 2002;123:737-745.
- Lockshin R. A., Zakeri ZF. Programmed cell death: new thoughts and relevance to aging. J Gerontol. 1990;45:B135-140.
- Lockshin R. A., Zakeri Z. Apoptosis, autophagy, and more. Int. J. Biochem. Cell. Biol. 2004;36:2405-2419.
- Medawar P. B. The future of life expectancy. Clin. Orthop. 1985;201:2-8.
- Medvedev Z. A. An attempt at a rational classification of theories of ageing. Biol. Rev. Camb. Philos. Soc. 1990;65:375-398.
- Meites J. Remembrance: neuroendocrinology and aging. A perspective. Endocrinology. 1992;130:3107-3108.
- Nandy K. Neuroimmunology and the aging brain. Exp. Brain Res. 1982;Suppl. 5:123-126.
- Orgel L. E. The maintenance of the accuracy of protein synthesis and its relevance to ageing. Proc. Natl. Acad. Sci. U S A. 1963;49:517-521.
- Popper K. R., Science: problems, aims, responsibilities. Fed. Proc. 1963;22:961-972.
- Ram J. S. Aging and immunological phenomena–a review. J. Gerontol. 1967;22:92-107.
- Schmucker D. L., Vessey D. A., Wang R. K., James J. L., Maloney A. Age-dependent alterations in the physicochemical properties of rat liver microsomes. Mech. Ageing Dev. 1984;27:207-217.
- Strehler B., Hirsch G., Gusseck D., Johnson R., Bick M. Codon-restriction theory by aging and development. J. Theor Biol. 1971;33:429-474.
- Valenti G. Neuroendocrine hypothesis of aging: the role of corticoadrenal steroids. J. Endocrinol Invest. 2004;27 Suppl. (6):62-63.
- Von Hahn H. P. A model of “regulatory” aging of the cell at the gene level. J. Gerontol. 1966;21:291-294.
- Weinert B. T., Timiras P. S. Invited review: Theories of aging. J. Appl Physiol. 2003;95:1706-1716.
- Williams G. C. Pleiotropy, natural selection and evolution of senescente. Evolution. 1957;11:398-411.
- www.grg.org Gerontology Research Group.