• MC-F-005. Capítulo 5. Bases celulares del envejecimiento.
5.1 Introducción
El envejecimiento animal en general y el humano en particular se manifiesta en los sistemas, órganos y tejidos, los cuales están formados por células. Para entender el envejecimiento debemos, por lo tanto, analizar los procesos que éste ocasiona en las células. El objetivo de este capítulo es profundizar en el envejecimiento celular y sus componentes. No obstante, sabemos que las células están formadas por diversos tipos de moléculas y por esta razón en los capítulos siguientes abordaremos el envejecimiento en el nivel molecular.
Muchos de los conocimientos actuales sobre el envejecimiento celular se han obtenido de los cultivos de células o estudios in vitro, mientras que el comportamiento de esas mismas células en el organismo in vivo se conoce menos. No obstante no se puede obviar que un tipo de estudio precede al otro y que el análisis in vitro ha aportado grandes conocimientos al campo del envejecimiento.
En las células debemos diferenciar el envejecimiento global de la población del envejecimiento concreto de una de ellas. Las células germinativas de diversos tejidos (v. gr., epitelios) son capaces de mantener la población celular por proliferación pero también están sometidas de forma individual a procesos de eliminación por muerte. Si cuando una de estas células se divide in vitro, se selecciona una sola de las células hijas al azar y sucesivamente se toma sólo una en cada división, inevitablemente el linaje acabará desapareciendo, pues pronto o tarde un proceso letal ocurrirá y esa célula será la última del linaje. Por el contrario, si observamos una población de estas células veremos, de forma ocasional, células muertas, pero por supuesto, la población continuará creciendo. Así, concluimos que las líneas celulares individuales son finitas en el seno de una población que tiene un potencial infinito de crecimiento (Orgel, 1973). El mismo proceso se aplica a las células tumorales (v. gr., neuroblastoma, HeLa, etc.). Estas líneas celulares poseen una significativa proporción de células que no se dividen y mueren (rango 10-30%), pero la población en su conjunto, continúa creciendo de forma constante.
Las células de los organismos se pueden clasificar, basándonos en su capacidad de duplicación (mitosis), en tres tipos:
- A) Con capacidad proliferativa.
- B) Quiescentes.
- C) Fijas-postmitóticas. El organismo humano posee células de las tres variedades y como iremos viendo, el envejecimiento tendrá efectos diferentes en cada una de ellas. El mantenimiento en su totalidad de un organismo complejo como el humano depende, en una parte importante, del de sus poblaciones independientemente del tipo de célula concreta. Asimismo veremos que nuestra integridad funcional se verá afectada, de forma diferente, dependiendo de las características concretas de cada población específica.
5.2 El ciclo celular
Las células, elementos vivos, están en diversos estados de actividad la cual se encuentra inmersa en el denominado ciclo celular. Sabemos que las células, cumplen sus funciones específicas, se dividen originando nuevas células y mueren. Estos estados de actividad se encuentran regulados por el ciclo celular que consiste en las siguientes fases (Figura 1):
- Fase G1. En ella la célula cumple las funciones propias de su fenotipo (v.gr., sintetiza hormonas, colágeno, etc.).
- Fase S. En este período la célula comienza a sintetizar (S) el ADN, es decir a efectuar una copia de su información genética.
- Fase G2. La célula ya ha copiado el ADN y se prepara para comenzar el proceso de división.
- Fase M. En este período la célula se divide por mitosis (M) y origina dos células hijas que cada una de ellas entra en la fase G1 y comienzan sus ciclos celulares específicos.
- En esta Fase G1 pueden ocurrir tres situaciones:
- La célula originada puede, tras un período variable de tiempo, continuar su ciclo celular y entrar en fase S y sucesivas (células proliferativas).
- La célula originada se queda largo tiempo en fase G1 y sólo bajo condiciones muy especiales entra en fase S y sucesivas. Esta variedad de fase G1 larga se denomina fase G0 (células quiescentes).
- La célula se queda de forma permanente en esta fase G1 y nunca más progresará en el ciclo celular. Estas células se denominan fijas postmitóticas.
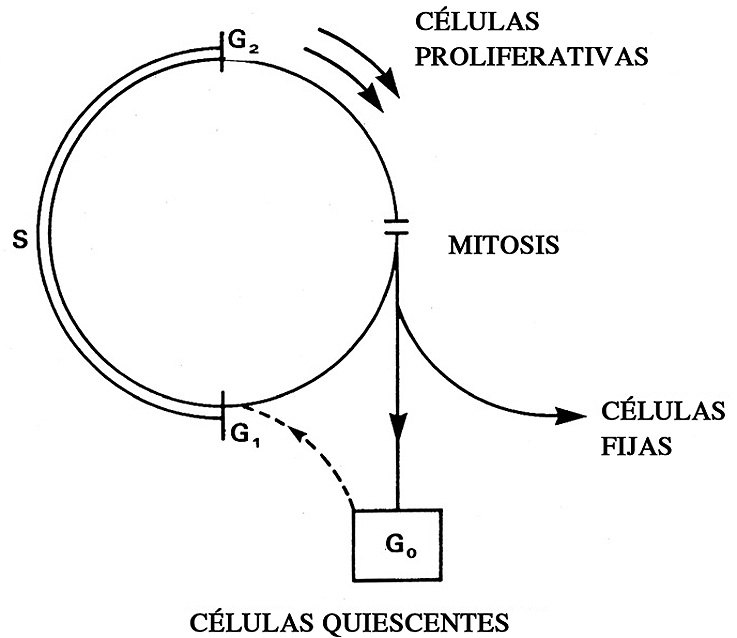
Figura 1. El ciclo celular consta de diferentes fases en cada una de las cuales la célula desarrolla funciones específicas. Desde el punto de vista del envejecimiento celular interesa prestar atención al comportamiento de las células hijas tras la mitosis. Así, las células pueden comportarse como células con capacidad proliferativa, quiescentes o fijas-postmitóticas (elaboración propia).
5.2.1 La mitosis
La mayor parte de las poblaciones celulares (células somáticas) que integran nuestro organismo son células que poseen capacidad proliferativa, es decir, son células que se dividen por mitosis y como consecuencia de este proceso se originan dos células hijas que poseen una carga genética semejante (genotipo) a la de la célula que las originó. La excepción a esta regla son las células germinales (espermatozoide y óvulo) que se originan por meiosis.
La mitosis es la parte del ciclo celular en la cual se producen los cambios morfológicos y funcionales específicos que conducen a la formación de dos células hijas. La mitosis tiene cuatro fases o estadios (profase, metafase, anafase y telofase). Para el objetivo de este apartado, más que el conocimiento íntimo de estas fases, tiene importancia el resultado de esta división. Como consecuencia de la división mitótica puede suceder que una o las dos células hijas expresen un fenotipo diferente a la célula de la que proceden. De esta manera tenemos las siguientes posibilidades (Figura 2).
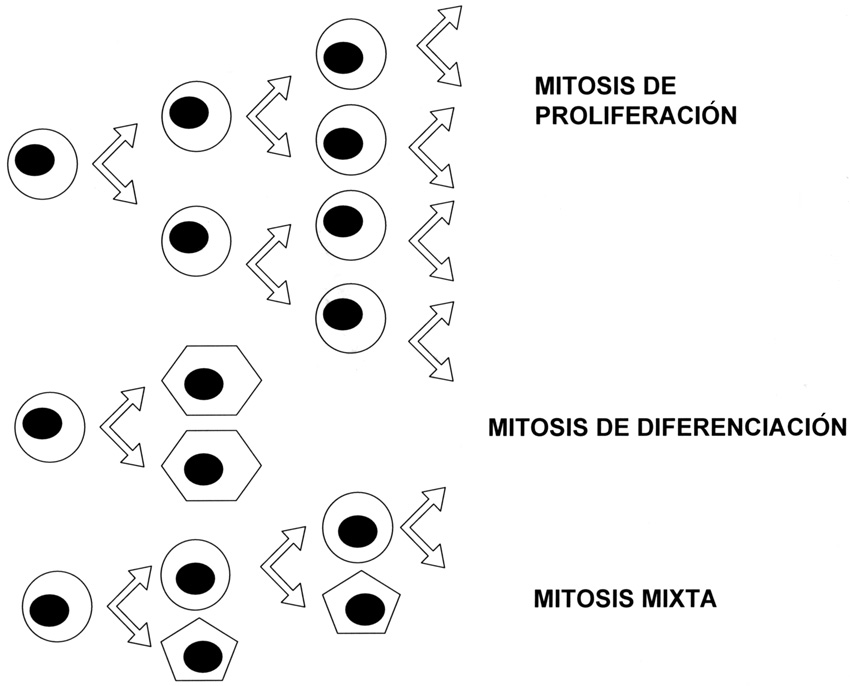
Figura 2. Diagrama que muestra los tres tipos de mitosis que pueden resultar de la expresión de un fenotipo igual o diferente al de la célula originaria (elaboración propia).
5.2.1.1 Mitosis proliferativa
Las dos células hijas son de características fenotípicas semejantes a la célula originaria. Este tipo de proliferación es el que se observa, entre otras, en la proliferación de los fibroblastos del tejido conjuntivo. Un fibroblasto se divide y origina dos fibroblastos de características semejantes al originario.
Una variedad de esta mitosis es la proliferación blástica. Este tipo de mitosis consiste en la rápida repetición de ciclos mitóticos que se producen en células, generalmente del sistema inmune, como consecuencia de la activación de un precursor determinado ya sea linfocito T (tímico) o linfocito B (médula ósea). La proliferación blástica tiene un límite en el tiempo que viene marcado por la expresión de proteínas (interleucinas) que desactivan el proceso proliferativo.
5.2.1.2 Mitosis de diferenciación
Las dos células hijas poseen características fenotípicas diferentes a la célula de la que se originaron. Por ejemplo en la formación de los eritrocitos, el eritroblasto de tipo basófilo se divide para formar los de tipo ortocromático que son células con características diferentes a sus precursoras.
5.2.1.3 Mitosis mixta
En este proceso una célula conserva las características fenotípicas de la célula originaria y la otra expresa un fenotipo diferente. Este tipo de mitosis asegura que siempre queden células de reserva para que la población que originan se mantenga a lo largo de la vida del sujeto. Así, en los estratos basales o germinativos de los epitelios (v.gr., la epidermis) las células germinales se dividen y originan una célula germinal y otra que expresa un fenotipo diferente.
5.2.2 La capacidad proliferativa
Como ya hemos comentado desde el punto de vista de la capacidad proliferativa que tienen las células en un órgano específico éstas se dividen en tres grupos: células activas (proliferan), estables (quiescentes) y, permanentes (fijas postmitóticas). Las características de estos tipos celulares y su repercusión en el proceso de envejecimiento son variables.
5.2.2.1 Células proliferativas
Son aquellas que poseen capacidad de división mitótica durante toda la vida del individuo. Esta capacidad proliferativa se va enlenteciendo a medida que el individuo va envejeciendo. Las células germinales de los epitelios (revestimiento y glandulares) y, las células de la estirpe hematopoyética pertenecen a este grupo.
5.2.2.2 Células quiescentes
Son células que se encuentran en estado de reposo postmitótico (fase G1). Dada la muy larga duración temporal de esta fase, algunos autores han considerado apropiado denominarla fase G0. Estas células, si son estimuladas por un agente externo, lesión, etc., pueden activarse (paso de G0 a G1), proseguir el ciclo mitótico (G1-S-M-G1-) y comenzar una fase activa de ciclos celulares originando nuevas células. Ejemplos de este tipo son los hepatocitos que tras una lesión en el hígado o post-exéresis parcial de la glándula pueden iniciar un ciclo de divisiones para regenerar el tamaño previo de este órgano.
5.2.2.3 Células fijas postmitóticas
Son aquellas que una vez han salido del ciclo mitótico (generalmente en las etapas intrauterinas) no vuelven a dividirse y quedan como una población permanente y estable. Todas aquellas células, de este grupo, que son eliminadas por acciones externas, envejecimiento, etc., no son renovadas y su eliminación está ligada a su pérdida definitiva. A este grupo pertenecen, entre las más significativas, la gran mayoría de las neuronas del sistema nervioso central (SNC) y las fibras musculares estriadas cardíacas (cardiomiocitos). Entenderemos, en este punto, que la eliminación de estas poblaciones asociada al envejecimiento tiene una especial repercusión por la importancia de las funciones vitales de estos órganos.
5.3 El ciclo celular in vitro: el «Límite de Hayflick»
Cuando se inició la técnica de mantener células en cultivo, para así facilitar los estudios experimentales, se creía que cualquier población celular de mamíferos podía crecer indefinidamente si se proporcionaban las condiciones apropiadas al medio de cultivo. Esto se ha visto que no es correcto, por el contrario, las células tienen una capacidad de proliferación limitada (salvo las germinales y tumorales).
La primera gran aportación en el campo de la investigación del envejecimiento in vitro la realizaron Hayflick y Moorhead (1961). Estos autores obtenían fibroblastos humanos fetales procedentes de biopsias (pulmón) y los cultivaban. Definieron las etapas por las cuales pasaban los cultivos celulares, fases que en la actualidad se han extendido a todos los tipos celulares in vitro.
- Fase I. Es el momento de establecimiento del cultivo primario (sembrado) de células.
- Fase II. Es el periodo más largo y comprende el crecimiento multiplicativo por mitosis de las células. Éste es el periodo en el cual se cuentan las divisiones celulares.
- Fase III. Es el momento en el cual el cultivo celular entra en fase de senescencia por agotamiento, las células ya no se dividen y tras un periodo variable de tiempo mueren.
Los fibroblastos fetales en cultivo crecen a un ritmo constante de divisiones mitóticas (Fase II), pero con el tiempo se reduce el ritmo de divisiones y cesa completamente tras un rango de 45-55 divisiones (Fase III). Esta investigación pionera describiendo el número finito de divisiones (conocido desde entonces como el “límite de Hayflick”) fue el inicio de una revolución en el recién estrenado mundo del envejecimiento celular (Figura 3).
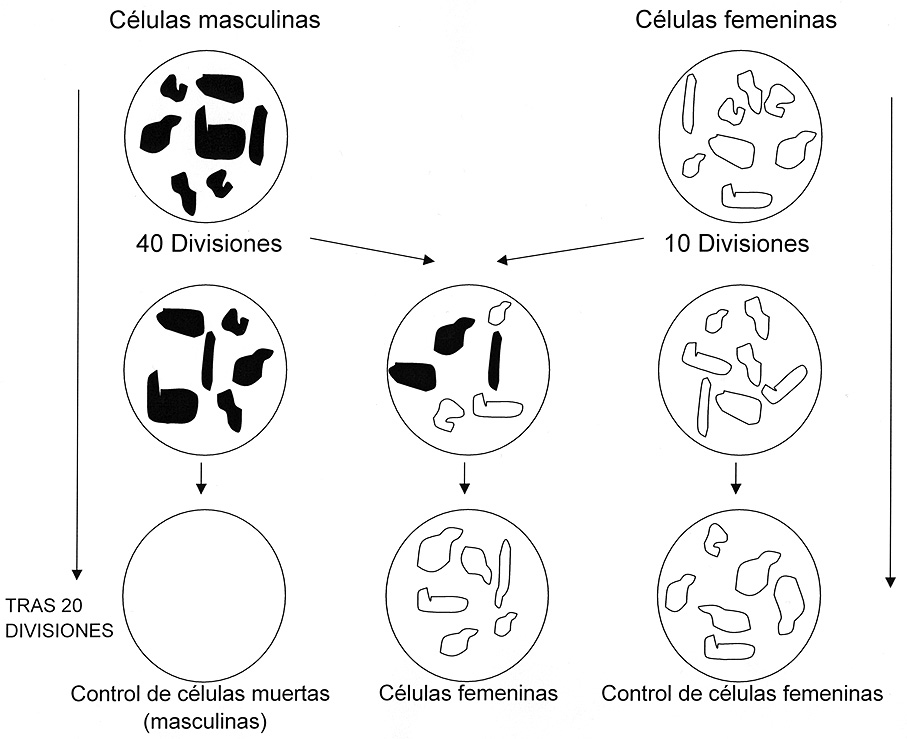
Figura 3. Modelo de los experimentos de análisis de la proliferación celular in vitro realizados por Hayflick y sus colaboradores. Un modo relativamente fácil de observar la capacidad proliferativa de los fibroblastos es comparar los fibroblastos femeninos y los masculinos gracias a la presencia o ausencia del cromosoma Y. Si tomamos un pool de fibroblastos masculinos que ya han pasado por 40 duplicaciones y los co-cultivamos con otro pool de fibroblastos femeninos que sólo han pasado por 10 ciclos mitóticos observaremos que pasado un número de duplicaciones en la placa de Petri donde habíamos continuado el cultivo sólo masculino ya todos han sido eliminados por muerte celular. Pero en la placa que contenía sólo fibroblastos femeninos observamos que aún el pool se sigue dividiendo, pues originariamente sólo había pasado por 10 divisiones. En la placa de Petri, donde habíamos co-cultivado ambos tipos de fibroblastos, observamos que sólo quedan los femeninos (adaptada de Hayflick, 1998).
Tras los estudios con fibroblastos fetales, estos autores analizaron fibroblastos de recién nacidos, adultos y viejos observando que dichas células tenían menor capacidad proliferativa a medida que las personas envejecían. Es decir, la edad del donante correlacionaba negativamente con la capacidad proliferativa. Finalmente, los estudios comparativos de células de diferentes especies muestran que el número de divisiones que alcanzan correlaciona, de forma directa, con la longevidad de la especie de la cual se obtienen las células (Figura 4). Los experimentos posteriores efectuando trasplantes cruzados de núcleos y citoplastos, mostraron que el “reloj mitótico” se encontraba en el núcleo celular (como estudiaremos más adelante).
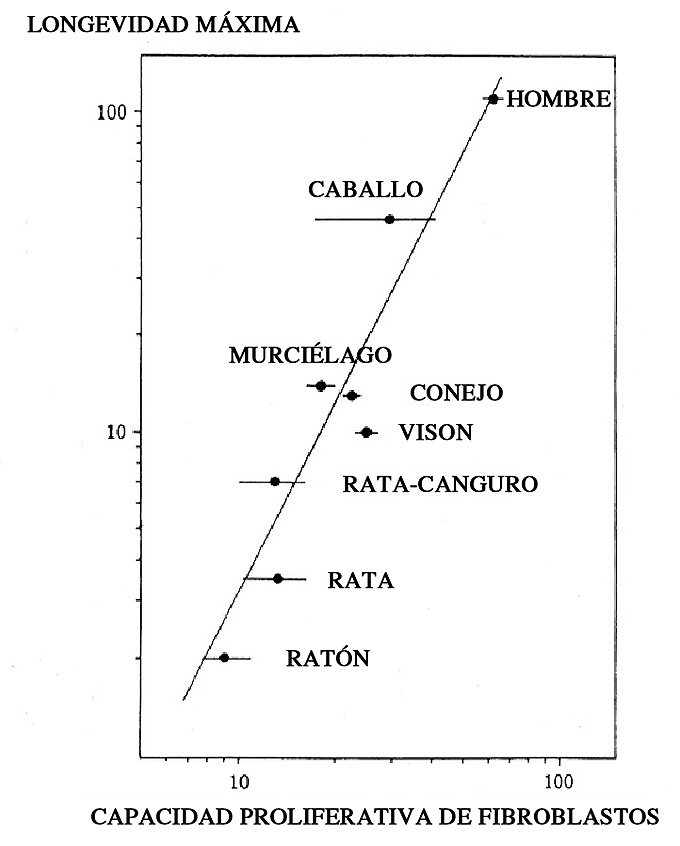
Figura 4. En el eje de abscisas figura la capacidad proliferativa de los fibroblastos in vitro y en el eje de ordenadas la longevidad de la especie donante. Los valores en los ejes representan valores logarítmicos. Obsérvese que hay una correlación positiva entre la longevidad de la especie y la capacidad proliferativa de sus fibroblastos. Las barras horizontales indican la desviación típica (adaptado de Holliday, 1995).
Se puede decir que los fibroblastos de los niños se comportan como células proliferativas para asegurar el desarrollo. Están en un continuo proceso proliferativo para de esta manera asegurar el correcto incremento en masa corporal asociado al crecimiento y la maduración. Además de proliferar estas células se encargan de sintetizar los diversos componentes de la matriz extracelular ya sean proteoglicanos o elementos fibrilares (colágeno, elastina o reticulina).
En los adultos, en condiciones normales, su papel proliferativo es menos importante y adquiere mayor preponderancia su papel de síntesis y mantenimiento de los componentes de la matriz extracelular. Se puede decir que en esta fase los fibroblastos in vivo son células quiescentes y si se produjera una lesión, entonces comenzarían una fase proliferativa para asegurar la reparación tisular. Ya en las personas ancianas, como consecuencia del envejecimiento, los fibroblastos limitan mucho su capacidad proliferativa y de síntesis y cuando mueren por finalización de su ciclo vital, ya no son reemplazados por nuevos fibroblastos. Ahora analizaremos los procesos por los cuales las células son eliminadas.
5.4 La muerte celular: necrosis y adoptosis
Las células proliferativas, quiescentes y fijas-postmitóticas pueden ser eliminadas en cualquier momento de su ciclo celular. Esta eliminación puede estar mediada por mecanismos internos celulares o por la acción de agentes externos. La apoptosis es el proceso por el cual una célula entra en degeneración y termina con su eliminación al activarse un mecanismo intracelular (un proceso interno). Por las peculiaridades que presenta, también es conocida como “suicidio celular” o “muerte celular programada” (MCP). La necrosis es el resultado de la muerte y eliminación de la célula, pero en este caso se produce como consecuencia de la acción de un agente externo (traumatismo, etc.).
Aunque la apoptosis y la necrosis tienen un final común, cual es la eliminación de la célula afectada, ambos procesos como ya hemos comentado, tienen un inicio o desencadenante diferente. Pero lo más característico de ambos es que los sistemas que empleará la célula para conducir a su muerte son diferentes y, su conocimiento ha producido un importante avance en el campo de la investigación de la longevidad celular.
5.4.1 La necrosis
La necrosis de una célula sucede cuando algún agente externo (traumatismo, tóxico, agentes infecciosos, etc.) actúa sobre ella induciendo su muerte. Las células que degeneran ocasionan una serie de reacciones locales que conducen a respuestas de tipo inflamatorio que son probablemente la manifestación más importante de este proceso.
La acción del agente inductor de la necrosis produce una alteración en las membranas plasmática y mitocondrial, donde se alojan las bombas iónicas (fundamentalmente de Na+, K+ y Ca++) que se encargan de mantener el adecuado equilibrio iónico intra-extracelular. Esta alteración en los sistemas homeostáticos dispara un mecanismo de defensa frente a la alteración de la homeostasis. Así, el núcleo de la célula comienza a transcribir ADN con información para la síntesis de proteínas protectoras de la célula (hsp – heat-shock proteins-, chaperonas). En ocasiones estas proteínas son capaces de restaurar las funciones celulares, pero en otras no y es entonces cuando la célula continuará de manera inevitable hacia su destrucción.
Los iones Na+ y Ca++ comienzan a entrar en la célula y son acompañados de agua, para mantener el equilibrio osmótico, lo que determina que los diversos organoides celulares (mitocondrias, retículo, etc.) sufran un proceso de hinchazón y fragmentación intracelular (Figura 5). Asimismo el citosol se llena de agua y electrolitos y, la célula en su conjunto sufre un proceso de turgencia general que conduce a una vacuolización, ruptura de la membrana citoplasmática e inicio de una reacción inflamatoria por la liberación de moléculas proinflamatorias (Edinger y Thompson, 2004).
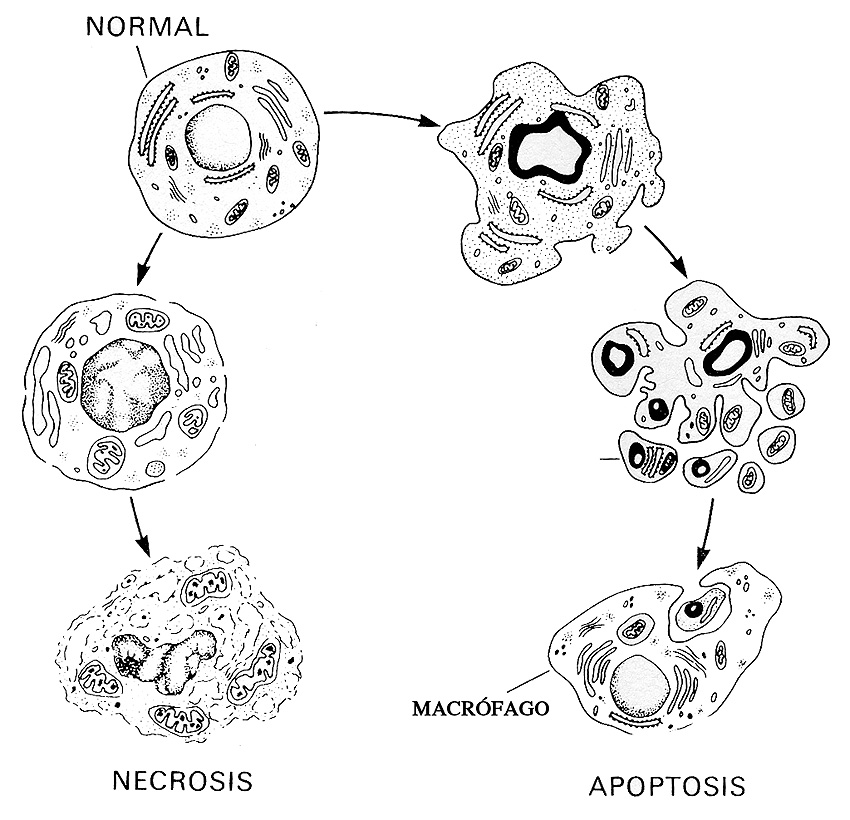
Figura 5. Esquema que muestra las dos vías principales de muerte celular. La necrosis implica la eliminación celular por alteración de la homeostasis y lleva aparejada una reacción inflamatoria. La apoptosis o muerte celular programada (MCP) es un proceso más selectivo por el cual las células son eliminadas y no se acompaña de inflamación. En este caso los macrófagos de la zona fagocitan los restos celulares (cuerpos apoptóticos) (adaptada del Libro de Anatomía Patológica de Robbins, 2004).
Los macrófagos locales, células con capacidad fagocítica del tejido muerto, comienzan un proceso de fagocitosis para eliminar los restos celulares necróticos. Si la población celular en necrosis es muy elevada, puede ser necesario el reclutamiento de más células que actúen en el proceso de limpieza como son los monocitos, que abandonarán el torrente sanguíneo para ingresar en el tejido lesionado, donde se transforman en macrófagos para incrementar la fagocitosis. Esto se desarrolla en el contexto de una reacción inflamatoria y unido a otras manifestaciones producirá las expresiones clínicas (calor, dolor y rubor) y bioquímicas (liberación de interleucinas, etc.) ya conocidas. La necrosis tiene una significación funcional menos importante que la apoptosis, desde el punto de vista del envejecimiento.
5.4.2 La apoptosis
Desde el punto de vista del envejecimiento, el proceso de eliminación de células por apoptosis tiene una significación funcional más importante. Durante el desarrollo embrionario y en las fases posteriores además de la proliferación celular se produce, de forma fisiológica, un proceso de remodelación de los órganos de la economía que implica la muerte “programada” de numerosas células. Sin este proceso de muerte celular programada nuestro organismo tendría una morfología difícil de reconocer y probablemente muchas de sus funciones estarían comprometidas. Por medio de la MCP se eliminan células que después de haber cumplido sus funciones, fundamentalmente en el desarrollo, deben ser eliminadas.
Si bien, durante el desarrollo, el proceso de MCP era bien conocido, fueron los estudios de Kerr et al., 1972, los que mostraron que representaba la forma “natural” de eliminación de células a lo largo de toda la vida del organismo, incluido el envejecimiento. Estos autores sugirieron que la MCP que ocurría en el adulto debía denominarse apoptosis (del griego “caerse”), en semejanza a la caída otoñal de las hojas de los árboles.
Cuando lo observamos al microscopio el proceso de apoptosis se caracteriza por el hecho de que la célula adquiere una morfología arrugada a la cual se asocian cambios específicos en el núcleo y el citoplasma (Figura 5). El núcleo cambia notablemente de forma y se aprecia como la cromatina, que normalmente está en forma de eucromatina o cromatina dispersa (indica actividad transcripcional del ADN), comienza a concentrarse formando cromatina condensada o heterocromatina (indica que el ADN no está transcribiendo). Finalmente todo el núcleo se hace muy denso por la condensación total de la cromatina (falta total de actividad transcripcional del ADN). La consecuencia última de este proceso es la falta de síntesis de ARN mensajero, ribosómico y de transferencia, la imposibilidad de la síntesis de proteínas y la consiguiente muerte y fragmentación de la célula. Este proceso de fragmentación se manifiesta morfológicamente por la aparición de diferentes vesículas esféricas (cuerpos apoptóticos), rodeados de membrana celular, que contienen diversos organoides citoplasmáticos degenerados. Estos cuerpos apoptóticos van siendo fagocitados por los macrófagos sin ningún tipo de reacción inflamatoria acompañante. Esta ausencia de reacciones locales del tipo inflamatorio es fundamental para entender la “limpieza” biológica del proceso de apoptosis en contraposición al proceso de necrosis.
El mecanismo interno que constituye la muerte celular por apoptosis se puede desencadenar por estímulos de origen extracelular o intracelular. El estímulo extracelular más frecuente, durante el desarrollo, es la falta de factores tróficos encargados de mantener la funcionalidad celular (v. gr., factor de crecimiento neural –NGF–). Las señales extracelulares en el adulto, entre las que destacan las moléculas de la familia del factor de necrosis tumoral, activan la vía extrínseca de la apoptosis por medio de su unión a receptores específicos de la membrana celular (apoptosis mediada por receptor). Los estímulos intracelulares más típicos son: la expresión de mensajes genéticos de suicidio celular, la hipoxia celular o que la célula no pase los controles –check-points– para entrar en mitosis, como estudiaremos más adelante (capítulo dedicado a la reparación del ADN).
Sea cual sea el inductor de la apoptosis (extra o intracelular), la primera reacción por parte de la célula, es la expresión de genes para la síntesis de un tipo particular de proteínas con alta actividad enzimática (proteasas). Concretamente las primeras proteasas identificadas que actúan en la apoptosis son las del tipo ICE, así denominadas por su parecido estructural con la Interleukin-1 Converting Enzyme (actualmente se denomina caspasa 1 y se han identificado más de 11 tipos). Cuando estas proteasas se activan, actúan sobre otras proteínas celulares o sobre el ADN nuclear originando su destrucción.
Basándose en sus funciones proapoptóticas, las caspasas se han dividido en dos grupos: caspasas iniciadoras y caspasas efectoras. Las iniciadoras actúan sobre las efectoras que son en definitiva las que degradan múltiples sustratos, incluyendo proteínas estructurales y enzimáticas en el núcleo y el citoplasma celular. Además las mitocondrias se afectan por el daño apoptótico y se origina la liberación del citocromo-c y la formación de apoptosomas (complejos de proteínas conteniendo el citocromo-c). Una vez que se forma el apoptosoma se le une la caspasa-9, desencadenando una cascada de reacciones de proteolisis que conducen a la muerte celular.
5.4.3 Inmunosenescencia
El sistema inmune posee dos vías para responder a los antígenos: la respuesta inmune celular y la humoral. La inmunidad celular implica a las diferentes familias de linfocitos T, mientras que la respuesta de inmunidad humoral implica a los linfocitos de tipo B.
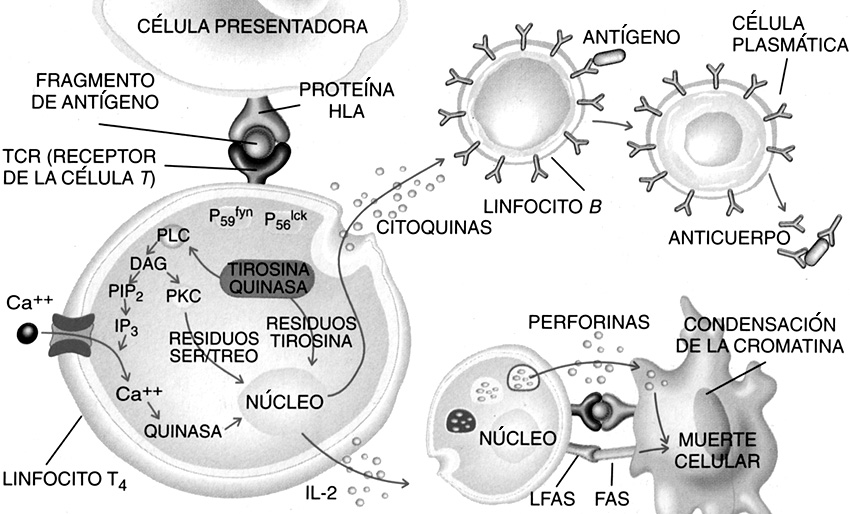
Figura 6. Esquema que muestra las vías de activación de las respuestas de inmunidad celular y humoral. El linfocito T4 (CD4+) se activa por la célula presentadora de antígenos y libera citoquinas que a su vez activan a linfocitos B para la formación de anticuerpos. Por otra parte también la célula CD4+ activa linfocitos citotóxicos (CD8+) que liberan perforina que agujerea la membrana del agente extraño y produce su destrucción (imagen tomada de lyC; adaptado de López Moratalla, 1998).
5.4.3.1 Inmunosenescencia celular
El modelo celular más ampliamente utilizado para el estudio de la apoptosis ha sido el linfocito de origen tímico (célula o linfocito T). El timo es un órgano linfoide primario que tiene como función fundamental la formación de linfocitos T. En las primeras etapas del desarrollo uterino (semanas 7-8), el saco vitelino forma linfocitos inmaduros que, vía el torrente sanguíneo, llegan a colonizar el timo (timocitos) que en esos momentos se está formando. La función de los timocitos es proliferar en un ambiente libre de antígenos y formar de esta manera linfocitos T maduros, reconocibles porque ya poseen en su superficie receptores específicos de estas células (receptor T). Las células T maduras abandonan el timo y van colonizando el resto de órganos linfoides y tejidos conjuntivos, donde ejercen una función de defensa frente a microorganismos invasores. Además vigilan la composición molecular del organismo y destruyen aquellas células que expresan mutaciones que pueden conducir a la formación de neoplasias.
Lo que nos interesa resaltar del timo y de los linfocitos T son dos peculiaridades. En primer lugar, un aspecto importante referido a la maduración de los linfocitos T, es que la gran mayoría de ellos (95%) no cumplen los criterios biológicos de madurez inmunológica y entran en un proceso de apoptosis. Esto se debe a una selección negativa que impide la maduración de linfocitos T auto-reactivos. De esta manera se eliminan las células T que reconocen lo propio como extraño, patología que se encuentra en la base de las enfermedades autoinmunes. En segundo lugar, el timo es un órgano transitorio, pues, después de sembrar de linfocitos T nuestro organismo, llegada la pubertad comienza a degenerar (la llamada involución etaria) y va siendo sustituido por tejido conjuntivo y material graso de tal manera que en el adulto este órgano no es ya reconocible (Pantelouris, 1973). Algunos autores han señalado la desaparición del timo como el principio del envejecimiento.
Las células T también envejecen, en el sentido de que su activación se vuelve más lenta y menos eficaz y la respuesta proliferativa al estímulo de la citoquina IL-2 está muy disminuida. Además unen una proteína llamada FAS-ligando (FAS-L o LFAS) a la proteína FAS de la célula a destruir. FAS es una proteína transmembrana que sirve, por medio de su dominio externo, para informar a la célula de las variaciones en el microambiente extracelular. La activación de FAS induce el inicio de la apoptosis y los linfocitos T liberan perforinas que crean agujeros en la membrana de la célula a destruir. El proceso de envejecimiento repercute de forma importante en la calidad y cantidad de la respuesta inmune.
Para activar la inmunidad celular, el antígeno es fagocitado y procesado por los macrófagos (Figura 6). El antígeno así procesado se incorpora a la membrana celular del macrófago ligado a proteínas del sistema HLA (sistema de histocompatibilidad), quien lo presenta al linfocito T. Estos macrófagos, llamados células presentadoras de antígenos activan a un subgrupo de células T vírgenes denominados CD4+ o linfocitos helper. Los CD4+ activados comienzan a liberar citoquinas y activan a linfocitos CD8+ citotóxicos que producen la lisis de las células afectadas, la bacteria intrusa, etc. Pasada la respuesta celular, algunos linfocitos que reconocen el antígeno nuevo que ha penetrado en el organismo quedan como centinelas ante posibles reentradas y se denominan linfocitos-T memoria (Figura 6).
Con el envejecimiento, la capacidad proliferativa de los linfocitos va disminuyendo. Se ha visto que los linfocitos T derivados de neonatos tienen una capacidad mitótica de 52 divisiones, los de adultos-jóvenes (20-30 años) alcanzan las 40 divisiones y aquellos de ancianos (70-90 años) sólo llegan a 32 divisiones (McCarron et al., 1987).
La proliferación conduce al progresivo acortamiento de los telómeros (porciones más distales de los cromosomas) hasta un punto crítico de longitud mínima que conduce a la apoptosis. La medición de la longitud de los telómeros ha mostrado que los de las células CD4+ de los jóvenes tenían una longitud de 10-12 kb. Se considera que por debajo de 5 kb se ocasiona el suicidio celular (apoptosis). En este sentido tiene gran importancia el observar que los telómeros analizados de personas centenarias mostraron una longitud de 7,5 kb. Esta inusual longitud en los telómeros de los linfocitos de las personas centenarias ha sugerido que el mantenimiento de una adecuada actividad inmune es uno de los pilares que condiciona la longevidad como veremos más adelante.
Respecto de los linfocitos T memoria, sabemos que persisten durante largo tiempo en nuestro organismo, pero no de manera indefinida. Esta duración se ha sugerido que es dependiente del antígeno que reconozcan y de las características y peculiaridades propias de la genética de cada individuo. El mantenimiento de la memoria inmunológica puede ser problemática en personas muy mayores, pero también en los jóvenes sometidos a estrés inmunológico crónico (tumores, infestación por parásitos, infecciones virales persistentes, etc.).
5.4.3.2 Inmunosenescencia humoral
La inmunidad humoral se caracteriza por la participación de los linfocitos B que actúan frente a los antígenos con respuestas de producción de moléculas específicas denominadas anticuerpos (inmunoglobulinas). Pasada la respuesta de inmunidad humoral, quedan algunos linfocitos B memoria y células plasmáticas que se pueden reactivar ante la nueva entrada del antígeno que las programó. Se ha visto que con el envejecimiento se reduce la afinidad de los anticuerpos frente a los antígenos específicos. Además en las respuestas inmunes humorales que se producen en edades tardías se ha visto que se incrementa la cantidad de autoanticuerpos.
Con el envejecimiento se va perdiendo la capacidad del organismo para renovar la población de linfocitos “vírgenes”, de tal manera que ante un antígeno nuevo existen pocas posibilidades de encontrar una célula capaz de interaccionar con él y desencadenar la respuesta de inmunidad. Del mismo modo también van disminuyendo las diversas poblaciones de linfocitos T y B memoria pues no son renovadas, fruto del envejecimiento celular. La capacidad de síntesis de anticuerpos está disminuida y lo mismo la de formación de nuevas inmunoglobulinas.
La inmunosenescencia explica:
- La reacción de hipersensibilidad retardada que ocurre en la piel de la personas mayores (Dworsky, et al., 1983).
- Que las personas mayores sean más sensibles a infecciones banales que las jóvenes (gripe, etc.).
- Que las vacunaciones en las personas mayores tengan menos éxito al no producir la inoculación de los antígenos la respuesta antigénica apropiada (vacuna antigripal, etc.).
- El incremento del número y malignidad de las neoplasias al permitir el sistema inmune por su envejecimiento la presencia y proliferación de células mutadas.
- Un decremento de las enfermedades autoinmunes.
- Por otra parte, una ventaja de la inmunosenescencia es el hecho de que los transplantes de tejidos u órganos son tolerados más fácilmente que en los jóvenes y son necesarias dosis más bajas de fármacos inmunosupresores para impedir el rechazo frente al nuevo injerto.
Un aspecto muy interesante respecto a la relación entre envejecimiento y respuesta inmune es el hecho observado en personas centenarias de que los parámetros citológicos y bioquímicos que marcan el estado del sistema inmune (ver capítulo de biomarcadores del envejecimiento) están en valores próximos a los encontrados en adultos de 40 años (Franceschi, et al., 1995). Este hecho explicaría de algún modo que el correcto funcionamiento del sistema inmune juega un papel fundamental en la longevidad, dadas las importantes acciones de este sistema en el mantenimiento de nuestra integridad.
5.5 Envejecimiento de las células somáticas con capacidad proliferativa
Como hemos comentado al inicio de este capítulo, las células que más han aportado al conocimiento del envejecimiento in vivo e in vitro han sido los fibroblastos y sabemos que los fibroblastos tienen establecido un número determinado de divisiones mitóticas. Además si se congelan en nitrógeno líquido diversos cultivos de fibroblastos en diferentes etapas de sus ciclos proliferativos (tras 10, 20, 30 y 40 divisiones), y se dejan pasar varios años, una vez se produce la revitalización de las células estas tendrán, respectivamente, nuevos ciclos (de 40, 30, 20 y 10 divisiones) hasta su apoptosis. Es decir la suma de divisiones antes y después de la congelación es de 50. La muerte celular no suele ocurrir inmediatamente después de la última división mitótica, por el contrario, una célula puede permanecer durante largos períodos de tiempo en la última interfase antes de entrar en apoptosis. Este estado sería una especie de pseudo-quiescencia previa a la muerte celular que se denomina “senescencia celular replicativa”. Estas células no pueden sintetizar ADN (no entran en fase S) y están definitivamente paradas en la fase G1, aspecto que las distingue de las verdaderas células quiescentes.
Para determinar que el reloj mitótico (límite de Hayflick) está en el núcleo se prepararon fibroblastos a los cuales se les extrajo el núcleo tras el tratamiento con citocalasina B. Se obtienen, de esta manera, células anucleadas (citoplastos) que pueden vivir varios días. Si en ese tiempo introducimos el núcleo de otra célula este citoplasto con el núcleo cedido vuelve a su actividad celular. De esta manera transfiriendo núcleos jóvenes a citoplastos viejos y núcleos viejos a citoplastos jóvenes se determinó que el reloj mitótico se encontraba en el núcleo (Figura 7).
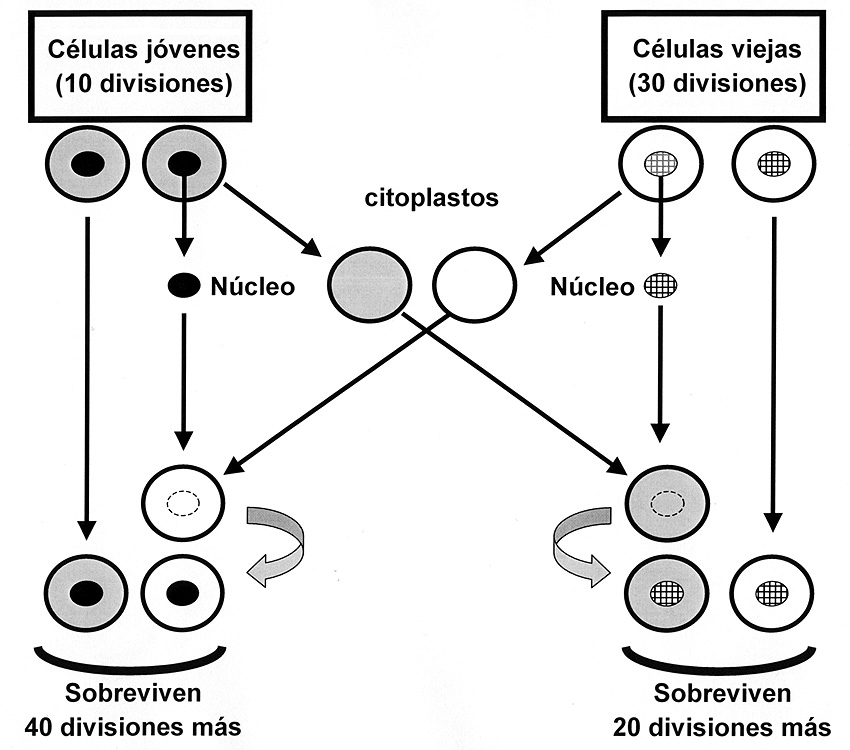
Figura 7. Los citoplastos son corpúsculos que se obtiene enucleando una célula determinada y debido a la falta de núcleo suelen vivir in vitro un par de días. Estos citoplastos pueden ser revitalizados si se les introduce otro núcleo y continúan sus ciclos mitóticos. Este experimento demostró que el “reloj mitótico” se encontraba en el núcleo. Los citoplastos más característicos de nuestro organismo son los glóbulos rojos que poseen una vida media de 120 días (adaptado de Hayflick, 1998).
5.5.1 Telómeros y envejecimiento
Actualmente la teoría más aceptada para explicar el límite de Hayflick es la hipótesis de la telomerasa (Shay y Wright, 2001). Los extremos de los cromosomas (telómeros) están formados por repeticiones no codificantes de un hexanucleótido (TTAGGG) que se repite miles de veces. El ADN telomérico se acorta en cada división y llegado un límite mínimo la célula entraría en apoptosis. La falta en la copia total del telómero se debe al peculiar sistema de copiado de la hebra de ADN en la síntesis de los fragmentos de Okazaki (que estudiaremos más adelante).
Se ha visto que las células germinales y las tumorales expresan telomerasa y por esa razón se pueden dividir de manera indefinida, pues, llegado el momento de la síntesis de ADN la telomerasa recupera la longitud inicial de los telómeros. Dado que no todos los telómeros de los 23 pares de cromosomas son de la misma longitud, parece que el telómero del cromosoma 3 (que es el más corto) es un serio candidato a ser el iniciador del proceso de apoptosis. Además cuando se incluye el cromosoma 3 en cultivos de células tumorales, éstas paran el proceso de duplicación. Se ha asignado al locus 3p12 o al 3p14 el posible papel de “reloj mitótico”. Este punto abre una nueva puerta a la investigación en la relación telomero-envejecimiento celular (como veremos en el capítulo dedicado a las bases bioquímicas del envejecimiento).
Las células germinales poseen actividad telomerasa como hemos dicho. Por el contrario las células somáticas no presentan actividad telomerasa y con cada división los telómeros se acortan y llegado un número de divisiones entran en senescencia celular por acortamiento crítico de los telómeros y tras un periodo más o menos largo mueren. Si estas células somáticas se transforman en células tumorales, la telomerasa se vuelve activa y las células tras cada mitosis recuperan la longitud de los telómeros de tal forma que se vuelven inmortales (Figura 8).
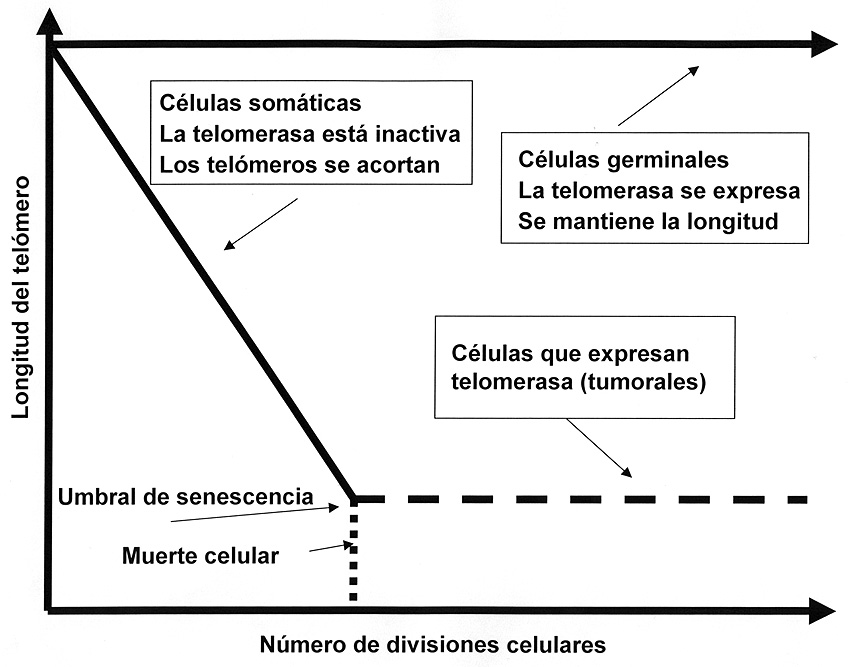
Figura 8. Se muestran diversas fases de la actividad del enzima telomerasa y sus repercusiones sobre la longevidad de las células (adaptado de Greider y Blackburn, 1996).
En la actualidad sabemos que las células cancerígenas en general expresan la enzima telomerasa que se encarga de regenerar los telómeros tras cada división mitótica, lo cual hace que las células tumorales sean inmortales. En sentido contrario la telomerasa también puede ayudar a ciertas células a regenerarse (Natesan, 2005).
5.5.2 Los gametos
Los datos existentes sobre la longitud de los telómeros en las células germinales humanas (ovocito y espermatozoide) y del zigoto in utero son escasos, aunque dada la facilidad de su obtención conocemos más sobre los gametos masculinos. La longitud de los telómeros en los gametos masculinos es excepcionalmente larga, en comparación con las células somáticas. Esta diferencia parece razonable si, como se ha propuesto, la longitud de los telómeros regula el envejecimiento celular.
En las espermatogonias los cromosomas están distribuidos al azar en el núcleo celular, pero una vez comienza el proceso de meiosis, los cromosomas meióticos se organizan y esto hace que los telómeros en los espermatocitos primarios tengan una organización espacial muy precisa. En esta fase, los telómeros se relacionan con la membrana nuclear. De hecho una de las funciones de los telómeros es permitir el anclaje de los cromosomas meióticos en la membrana nuclear para facilitar los procesos de intercambio de genes entre cromatides homólogas. Al nacimiento no hay diferencias significativas entre la longitud de los telómeros de los varones y las hembras. Las diferencias en longitud encontradas con el envejecimiento (telómeros de mujeres más largos que los de los varones) aún no se han podido explicar.
Las células germinales precursoras (ovogonias y espermatogonias) que originan los gametos por el proceso de meiosis poseen actividad telomerasa. En los varones la máxima actividad de la telomerasa se ha detectado en los espermatocitos primarios y va descendiendo en los espermatocitos secundarios. Finalmente, no se detecta actividad telomerasa en las espermátides ni en los espermatozoides del eyaculado.
Respecto de las mujeres se sabe que la actividad de la telomerasa en los ovocitos primarios es alta y no se detecta dicha actividad en la fase de ovocito secundario (ovulado). Cuando se produce la fecundación y se forma el zigoto, la actividad de la telomerasa vuelve a incrementarse en ese preciso momento (Figura 9). Durante las primeras divisiones mitóticas del zigoto, la actividad telomerasa vuelve a descender, pero desde la fase de ocho células hasta la fase de blástula se vuelve a incrementar dicha actividad.
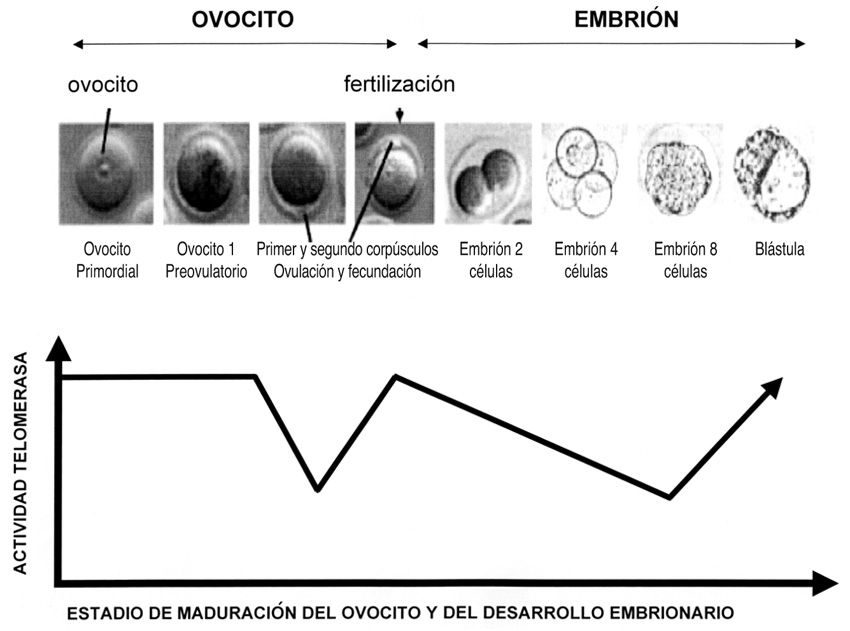
Figura 9. Se muestran diversas fases del proceso de maduración del ovocito, su fecundación y primeras fases de proliferación hasta el estadio de blástula. Se correlacionan estas fases con la expresión de la actividad del enzima telomerasa (elaboración propia; imágenes tomadas de Bekaert et al., 2004).
En la vida intrauterina, las células analizadas de diferentes tejidos poseen telómeros de la misma longitud (leucocitos, piel y arteria umbilical). Tras el nacimiento los niveles de telomerasa decrecen en casi todos los tejidos pero se mantienen en las localizaciones específicas donde se renuevan los epitelios y las células sanguíneas.
Se ha propuesto que el “reloj mitótico” en humanos estaría ligado a los cromosomas X y 3 (en ratones al cromosoma 2) al ser estos los que poseen unos telómeros más cortos. Esta propuesta no ha podido ser demostrada, pues, en cada mitosis el acortamiento de los telómeros no es proporcional a su longitud, ni se pierde la misma cantidad de kilobases (kb).
En el adulto las células que aún conservan actividad de la telomerasa se han dividido en tres grupos dependiendo de los niveles de dicha expresión. El nivel más elevado de actividad se encuentra en el testículo (espermatocitos primarios). Un nivel intermedio de actividad se ha encontrado en las células de los centros germinativos de los folículos linfoides (linfoblastos B) y el nivel más bajo de actividad de la telomerasa se encuentra en las células germinativas de los epitelios (folículo piloso, piel, tracto gastrointestinal y endometrio), excluidas las células que perdieron su actividad telomerasa una vez terminado el desarrollo, como es el caso de las neuronas y los cardiomiocitos.
5.5.3 Clonación y telómeros
La famosa oveja Dolly nació el 5 de julio de 1996 y fue el primer animal clonado a partir de una célula adulta (el núcleo de una célula epitelial de la glándula mamaria). Dolly tuvo un primer parto en 1998 (una cría) y otro en 1999 (tres crías). La especie de Dolly tiene una esperanza de vida de 12 años, pero ella murió (eutanasia) a los 6 años de edad cronológica aquejada de alteraciones propias del envejecimiento de esta especie (artrosis y alteraciones pulmonares). El estudio de los telómeros de Dolly reflejó que al proceder el núcleo con la información genética (cromosomas) de un animal de 4 años, al nacer ya tenía 4 años de vida biológica. Como demostró el análisis telomérico las células de Dolly tenían un acortamiento superior al que le corresponde a las ovejas de su misma edad cronológica (Wilmut, 2003). De esta manera se determinó que Dolly tenía 10 años biológicos cuando murió (4 de célula originaria y 6 de oveja). Posteriormente, se ha procedido a la clonación de terneros con células fetales. Este experimento ha mostrado que estos terneros poseen telómeros más largos que sus compañeros de la misma edad cronológica (Tian et al., 2000). Los experimentos de clonación han vuelto a poner el punto de mira en el envejecimiento, por acortamiento de telómeros.
5.5.4 Progeria y telómeros
Las alteraciones en la regulación de la longitud de los telómeros, en el desarrollo postnatal, se ha sugerido que pueden estar en la etiología de diversas enfermedades de tipo progeroide (Hutchinson–Gilford y síndromes de Werner y Bloom). El Hutchinson–Gilford o progeria infantil es una laminopatía (alteración en las laminas nucleares), originada por una mutación heterocigótica en el gen LMNA que codifica las laminas A y C. El síndrome de Werner, progeria del adulto, es una mutación en el gen WRN de la helicasa (necesaria para la copia del ADN). El síndrome de Bloom está causado por la mutación en el gen BLM de la helicasa. Estos síndromes, además del síndrome de Down, se caracterizan por un envejecimiento más o menos prematuro in vivo y una reducción de la capacidad proliferativa de las células in vitro, que muestran un acortamiento de los telómeros en las personas afectadas por estas patologías.
5.6 El envejecimiento de las células quiescentes
Dada la importancia que tiene el envejecimiento del sistema cardio-circulatorio en diversas patologías asociadas a la edad prestaremos, seguidamente, atención al envejecimiento de un tipo de célula quiescente; la célula endotelial (CE) que tapiza la luz de este sistema.
Las células endoteliales tienen una función fundamental, cual es, el facilitar el deslizamiento del plasma sanguíneo sobre su superficie y evitar, por medio de sus uniones estrechas, el paso de moléculas y elementos formes de la sangre entre las CE. Es a nivel de los capilares sanguíneos donde estas células facilitarán, por medio de mecanismos específicos, el intercambio de moléculas de forma bidireccional entre la sangre y los tejidos.
La integridad de la CE es esencial para la prevención de las alteraciones vasculares y de la arteriosclerosis, patología íntimamente ligada al envejecimiento humano con notables repercusiones de tipo sistémico. El envejecimiento está asociado a una pérdida de capacidad proliferativa de las CE y de esta forma, aquellas que son eliminadas por apoptosis, no suelen ser renovadas. Para cubrir este déficit, las células vecinas incrementan su tamaño. De hecho se ha sugerido que la apoptosis de la CE está en la base de la etiopatología de la arteriosclerosis (Vasa et al., 2000).
El envejecimiento de la CE está acompañado de alteraciónes en la superficie celular y en la síntesis de diversas proteínas endoteliales con actividad sobre la circulación, entre ellas la endotelina-1 y enzimas encargadas de la síntesis de óxido nítrico (NO). Se ha sugerido que el NO en niveles bajos actúa como un protector de la apoptosis endotelial.
La mayoría de los estudios de apoptosis endotelial se han realizado en cultivo, pero in vivo se ha visto que son células muy resistentes a la apoptosis y están protegidas frente al suicidio celular por algunas proteínas antiapoptóticas que ellas sintetizan a modo de mecanismo de defensa, tales como la FLIP. La proteína FLIP interfiere específicamente con la ya comentada vía FAS que induce la apoptosis. La vía de apoptosis en la CE es semejante a la de otras células (Urbich y Dimmeler, 2004) y es realizada por la activación de una familia de caspasas (ver más adelante). La apoptosis puede ser bloqueada por la inhibición de las caspasas vía la S-nitrosilación de un residuo esencial de cisteína. Sin embargo el envejecimiento inhibe la síntesis de NO por la CE, facilitando, en consecuencia, la apoptosis de la CE y finalmente conduciendo a la disfunción endotelial, un fenómeno patogénico base en el progreso de la arteriosclerosis. De hecho, todos los factores considerados como clásicos en la etiopatología de la arteriosclerosis, tales como; la oxidación de las lipoproteínas de baja densidad (LDL), las citoquinas proinflamatorias y la acción de niveles elevados de radicales libres de oxígeno se ha visto que actúan de forma directa induciendo la apoptosis de estas células.
5.7 Envejecimiento de las células fijas-postmitóticas
En el organismo humano existen diversos tipos celulares que una vez se han formado, generalmente en las etapas iniciales del desarrollo o en las primeras etapas postnatales, entran en una fase postmitótica fija (G1) que dura toda la vida del organismo al cual pertenecen. Las causas íntimas de este proceso de “paro” del ciclo se desconocen. Una característica general de estas células es el hecho de ser elementos muy modificados tanto desde un punto de vista funcional como morfológico. En estos tipos de células es difícil de aplicar el límite de Hayflick (acortamiento de telómeros) como determinante del envejecimiento, pues al no entrar en mitosis no se produce acortamiento telomérico. Se ha sugerido que dicho acortamiento se origina en las fases blásticas de estas células aunque esto es una sugerencia más que una confirmación. La acción de los radicales libres de oxígeno (estrés oxidativo), junto con el acúmulo de detritus celulares como efecto del catabolismo por el fallo de los sistemas de detoxificación de las moléculas y los organoides alterados, se han sugerido como procesos fundamentales en el envejecimiento de este tipo de células. A este grupo de células fijas-postmitóticas pertenecen, entre otras, las fibras musculares cardíacas (cardiomiocitos) y las neuronas.
5.7.1 Cardiomiocitos
Las fibras musculares estriadas cardíacas forman el miocardio cuya contracción rítmica permite el bombeo de la sangre por el sistema circulatorio para que sirva de vehículo a las moléculas fundamentales para el mantenimiento de la vida. Estas células son fijas-postmitóticas y acumulan, como consecuencia de su actividad celular, moléculas y orgánulos alterados (mitocondrias, lisosomas, etc.). En las células con capacidad proliferativa, gran parte de los organoides alterados, una vez digeridos por el aparato lisosomal celular, son eliminados por exocitosis y fagocitados por los macrófagos vecinos. En las células fijas este proceso de exocitosis no se produce y por lo tanto, los productos no degradados se acumulan en el citoplasma en forma de lipofuscina o pigmento del envejecimiento.
Desde el punto de vista bioeléctrico, el envejecimiento mitocondrial se caracteriza por una disminución del potencial de la membrana interna, además de un incremento en la formación de radicales libres de oxígeno. Estos aspectos sugieren que el acúmulo de lipofuscina y el daño mitocondrial tienen un mecanismo etiopatogénico común, que implica una autofagia imperfecta de los orgánulos citoplasmáticos que deben ser degradados. Además se ha observado que con el envejecimiento se produce un incremento del tamaño de las mitocondrias, probablemente debido a la imposibilidad para dividirse, y por la alteración de sus biomoléculas (ADN mitocondrial y de los lípidos y proteínas de las membranas).
5.7.2 Neuronas
Las neuronas al igual que las fibras musculares cardíacas deben detoxificar su citoplasma y núcleo de los diversos productos del metabolismo celular. Muchos de estos productos son tóxicos para la célula y del buen funcionamiento de estos sistemas de detoxificación dependerá el grado de funcionalidad celular. Superados unos niveles de alteración, la neurona entrará en apoptosis. En el SNC se produce, por estos motivos, la pérdida a lo largo del proceso de envejecimiento de numerosas neuronas. Dada la gran abundancia de estas células generalmente su pérdida no tiene ningún efecto secundario. Pero cuando la desaparición de neuronas tiene lugar en poblaciones específicas, aunque sea muy pequeña, entenderemos por qué su muerte ocasionará graves patologías. Esto es lo que sucede con la pérdida de neuronas en la sustantia nigra. En este núcleo cerebral se encuentran las neuronas que sintetizan el neurotransmisor dopamina que es fundamental para la coordinación fina de la actividad motora. Cuando estas neuronas (aproximadamente 500.000), comienzan a ser eliminadas, la disminución de los niveles de dopamina irá mostrando paulatinamente un tipo de patología que conocemos con el nombre de enfermedad de Parkinson.
5.7.3 Envejecimiento de los organoides
Ya hemos comentado que las células fijas-postmitóticas no explican su eliminación por la teoría del acortamiento de telómeros. En este caso ha sido implicada en este proceso la acción de los radicales libres de oxígeno (ver Capítulo 8) sobre las biomoléculas, además de la participación de diversos orgánulos y elementos moleculares de la célula. Entre estos elementos están algunos orgánulos citoplasmáticos como los lisosomas, las mitocondrias y los complejos moleculares proteosomas. Comenzaremos este apartado por el análisis de los organoides citoplasmáticos.
5.7.3.1 Las mitocondrias
Respecto del papel de las mitocondrias en la apoptosis debemos, primeramente, señalar el efecto matrilineal en su heredabilidad. Las mitocondrias del espermatozoide no penetran en el citoplasma del ovocito y por lo tanto todas las mitocondrias que posee la célula fecundada (zigoto) proceden de la madre. Se considera que si alguna mitocondria del espermatozoide (masculina) penetrara, es eliminada del zigoto.
Este hecho es de importancia fundamental pues explica, hasta cierto punto, que las mitocondrias del espermatozoide (masculinas) generen muchos radicales de oxígeno al suministrar energía al flagelo. La liberación de radicales dañaría el ADN del espermatozoide y por ello está muy condensado por prolaminas para evitar esta acción tóxica. Por el contrario las mitocondrias del ovocito no producen radicales de oxígeno o los pocos que producen son detoxificados para no dañar el ADN (en dictiotene). Al producirse la fecundación las mitocondrias del ovocito se reactivan y pueden comenzar a desarrollar sus funciones específicas.
La mitocondria juega un importante papel tanto en la vida como en la muerte de las células. La mitocondria tiene, además de su función en la respiración, un importante papel en la vía de señalización de la apoptosis que sirve para mantener la homeostasis de los tejidos de los organismos multicelulares (ver Apartado de Apoptosis). Como hemos visto son diversas las señales que desencadenan el proceso de apoptosis, pero casi todas ellas tienen un destino común, la mitocondria. La malfunción a cualquier nivel de la célula es trasladado a la liberación de factores apoptogénicos al espacio intermembrana de la mitocondria, lo que origina un fallo en la célula. Estos factores pueden contribuir tanto a un proceso apoptótico dependiente o independiente de caspasas.
5.7.3.2 Los lisosomas
Los lisosomas son vacuolas que contienen diversos enzimas líticos (hidrolasas ácidas) donde la mayoría de las proteínas de larga vida, lípidos y otras biomoléculas, además de los organoides citoplasmáticos son degradadas. La lipofuscina (pigmento del envejecimiento) es material intracelular rodeado de membrana que representa los restos del proceso de degradación lisosómica de diversos componentes celulares y que se acumula debido a que no puede ser degradado en su totalidad o eliminado por exocitosis (Figura 10). La teoría predominante es que la lipofuscina representa, fundamentalmente, los restos de la degradación lisosomal de las mitocondrias dañadas.
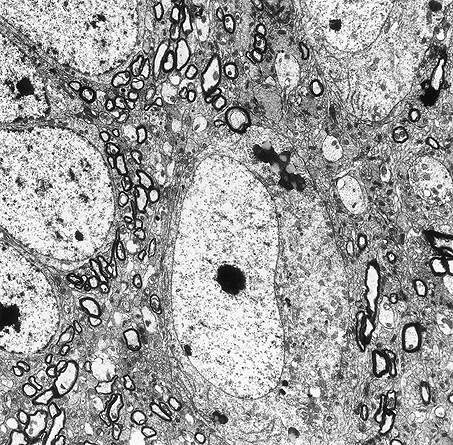
Figura 10. Neurona del hipocampo en la cual se observa la acumulación de lipofuscina en el citoplasma. Se ha sugerido que cuando este pigmento alcanza unos niveles críticos de densidad, altera la funcionalidad de la célula e induce su muerte (imagen original de Dámaso Crespo Santiago).
El papel de los lisosomas adquiere importancia capital en las células postmitóticas que no pueden renovar sus sistemas ellas mismas por exocitosis o en el proceso de división celular. En contraste, las células proliferativas diluyen continuamente sus deshechos por exocitosis o durante las sucesivas mitosis.
Inicialmente el proceso lísico implica la formación de un autofagosoma que contiene los orgánulos degenerados y que se fusiona con los lisosomas. Este proceso se denomina macroautofagia. En los lisosomas el material es descompuesto en moléculas más simples (aminoácidos, ácidos grasos y monosacáridos), que son reutilizados por la célula en actividades anabólicas. Normalmente, los lisosomas degradan la mayoría de las macromoléculas y organoides, para asegurar su reciclaje, pero un fallo en la síntesis de algún enzima lisosomal resulta en serias y a veces fatales enfermedades conocidas como enfermedades de almacenamiento lisosomal. En algunas enfermedades por disfunción lisosomal este pigmento se denomina “ceroide” (Terman y Brunk, 2004).
Las mitocondrias contienen macromoléculas oxidadas y experimentan una importante autogafocitosis. La degradación parcial de mitocondrias es una de las fuentes principales de lipofuscina. También contienen proteínas del tipo heme ricas en hierro y potencialmente pueden contribuir a la producción de radicales libres de oxígeno en los lisosomas tras su autofagocitosis. Además diversas proteínas de las mitocondrias se han localizado en los granos de lipofuscina. Todos estos datos sugieren que a medida que se acumula la lipofuscina se induce la apoptosis celular, “catástrofe por basura”.
5.7.3.3 Proteosomas
Muchas de las proteínas citosólicas, fundamentalmente las de vida corta, se descomponen en complejos multiproteínicos con efectos enzimáticos (multicatalíticos) llamados proteosomas. Los proteosomas son complejos de proteínas que actúan sobre otras proteínas que han sido marcadas específicamente para su destrucción por la unión de forma covalente de una tercera proteína de bajo peso molecular llamada ubiquitina. Se forman de esta manera uniones de proteínas alteradas y ubiquitina formando las denominadas proteínas ubiquitinizadas (ubiquitinización). Las proteínas ubiquitinizadas son, de esta forma, reconocidas por los proteosomas y degradadas. Por esa razón se considera el complejo ubiquitina-proteosoma como dos partes del mismo sistema. En las células de los mamíferos este complejo constituye la principal maquinaria proteolítica no lisosomal implicada en la degradación de proteínas. El proteosoma juega un papel fundamental en el turnover de las proteínas del citosol que están mal plegadas o alteradas, además participa en la activación esencial de funciones en la célula. El proteosoma está implicado en un amplio rango de reacciones celulares como la apoptosis, el ciclo celular, la diferenciación celular, la reparación del ADN y la degradación de importantes enzimas en las vías metabólicas.
Se ha sugerido que la acumulación de lipofuscina está asociada a la reducción de la actividad del proteosoma. La lipofuscina hace que los proteosomas sean menos funcionales pues estos se deben degradar en los lisosomas. Así, el incremento en la sensibilidad al estrés oxidativo y la reducción en la degradación lisosomal, a pesar de la abundancia de enzimas lisosomales pudieran, aparentemente, hacer a las células cargadas de este pigmento más vulnerables a los agentes patógenos y promover el desarrollo de diversas patologías (Figura 11). En particular, los cambios pueden implicar enfermedades neurodegenerativas como el Alzheimer y el Parkinson. En este sentido se la demostrado que la proteína ß-amiloide, que se acumula en los cerebros afectados, colocaliza con lipofuscina y enzimas lisosomales (Terman y Brunk, 2004). Asimismo el proteosoma está en la base de la inmunosenescencia por alteración en la degradación de las proteínas de los agentes infecciosos (como vimos en el apartado de inmunosenescencia).
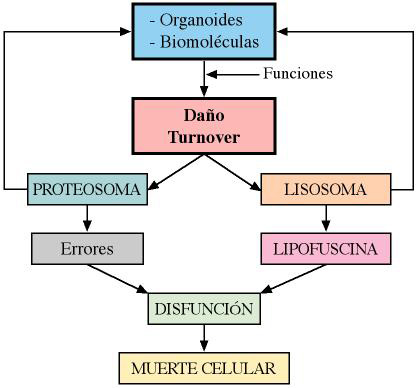
Figura 11. En este esquema se muestran las relaciones entre los diversos sistemas celulares de eliminación de organoides y biomoléculas. El acúmulo intracitoplasmático de proteínas alteradas no digeridas en los proteosomas y/o de lipofuscina como consecuencia de la degradación incompleta de mitocondrias, origina una disfunción que termina con la muerte celular (elaboración propia).
Respecto del envejecimiento cerebral se ha visto que los proteosomas disminuyen su funcionalidad por la acción del estrés oxidativo y la acumulación de daño en las proteínas que lo forman. La disfunción del proteosoma origina un acúmulo de proteínas alteradas que alteran la función de las neuronas. Esto se ha mostrado en el Parkinson y la enfermedad de Alzheimer (McNaught 2004). Diversos estudios sugieren que el fallo en el sistema ubiquitina-proteosoma es crítico para el acúmulo de agregados de proteínas en el citoplasma que aparecen como cuerpos de Lewy en el Parkinson. Los proteosomas de las personas centenarias se ha visto que se comportan como los de los jóvenes en relación a sus actividades proteolíticas (Chondrogianni et al., 2000).
Recientemente se ha propuesto como una aproximación terapéutica para diversas neoplasias la inhibición de la actividad de los proteosomas. De esta manera se acumularían en el interior de la célula numerosas moléculas alteradas que impedirían su normal funcionamiento y ocasionarían su apoptosis.
5.8 ¿Es comparable el envejecimiento in vitro al in vivo?
Como hemos visto en este capítulo, la mayoría de las investigaciones sobre envejecimiento celular (in vitro, senescencia replicativa, etc.), se han tratado de extrapolar a los posibles mecanismos que operan en el envejecimiento in vivo. En un principio no se puede generalizar y admitir sin ningún tipo de crítica que lo que sucede in vitro es equivalente a lo que sucede in vivo.
En organismos complejos como el hombre, las células se agregan para formar relaciones específicas en tejidos y órganos y tienen un microambiente particular que determina muchas de sus funciones. Así, in vivo un fibroblasto puede no finalizar sus ciclos mitóticos y de esta manera no alcanzar el límite de Hayflick, cuando por el contrario, en pocas semanas lo puede alcanzar in vitro.
No cabe duda de que el conocimiento de los procesos de envejecimiento ha sufrido un importante avance tras la introducción de los estudios del comportamiento de las células en cultivo. No obstante el paso siguiente no podía ser otro que el estudio del envejecimiento en modelos de organismos progresivamente complejos. En este sentido el siguiente capítulo aborda el estudio del envejecimiento en diversos modelos animales que han servido para profundizar en este proceso, incluyendo el análisis de los síndromes progeroides que cursan con un envejecimiento acelerado.
Referencias
- Bekaert S., Derradji H., Baatout S. Telomere biology in mammalian germ cells and during development. Dev. Biol. 2004;274:15-30.
- Chondrogianni N., Petropoulos I., Franceschi C., Friguet B., Gonos E. S. Fibroblast cultures from healthy centenarians have an active proteasome. Exp. Gerontol. 2000;35:721-728.
- Dworsky R., Paganini-Hill A., Arthur M., Parker J. Immune responses of healthy humans 83-104 years of age. J. Natl. Cancer Inst. 1983;71:265-268.
- Edinger A. L., Thompson C. B. Death by design: apoptosis, necrosis and autophagy. Curr. Opin. Cell Biol. 2004;16:663-669.
- Franceschi C., Monti D., Sansoni P., Cossarizza A. The immunology of exceptional individuals: the lesson of centenarians. Immunol Today. 1995;16:12-16.
- Greider C. W., Blackburn E. H. Telomeres, telomerase and cancer. Sci. Am. 1996;274:92-97.
- Hayflick L., Moorhead P. S. The serial cultivation of human diploid cell strains. Exp. Cell Res. 1961;25:585-621.
- Hayflick L. Biología celular del envejecimiento humano. Investigación y Ciencia, 1998, Temas 11:64-72.
- Holliday R. Understanding ageing. Cambridge University Press, 1995.
- Kerr J. F., Wyllie A. H., Currie A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br. J. Cancer. 1972;26:239-257.
- López Moratalla N. Sistema inmunitario y envejecimiento. Investigación y Ciencia, 1998, Temas 11:73.
- McCarron M., Osborne Y., Story C. J., Dempsey J. L., Turner D. R., Morley A. A. Effect of age on lymphocyte proliferation. Mech. Ageing Dev. 1987;41:211-218.
- McNaught K. S. Proteolytic dysfunction in neurodegenerative disorders. Int Rev Neurobiol. 2004;62:95-119.
- Natesan S. Telomerase extends a helping hand to progenitor cells. Trends Biotechnol. 2005;23:1-3.
- Orgel L. E. Ageing of clones of mammalian cells. Nature. 1973;243:441-445.
- Pantelouris E. M. Thymic involution and ageing. Exp. Parasitol. 1973;8:169-171.
- Shay J. W., Wright W. E. Ageing and cancer: the telomere and telomerase connection. Novartis Found Symp. 2001;253:116-125.
- Terman A., Brunk U. T. Lipofuscin. Int. J. Biochem. Cell Biol. 2004;36:1400-1404.
- Tian X. C., Xu J., Yang X. Normal telomere lengths found in cloned cattle. Nat Genet. 2000;26:272-273.
- Urbich C., Dimmeler S. Endothelial progenitor cells functional characterization. Trends Cardiovasc. Med. 2004;14:318-322.
- Vasa M., Breitschopf K., Zeiher A. M., Dimmeler S. Nitric oxide activates telomerase and delays endothelial cell senescence.
- Wilmut I. Dolly-her life and legacy. Cloning Stem Cells. 2003;2:99-100.