• MC-F-006. Capítulo 6. El envejecimiento de los organismos: modelos.
6.1 Introducción
En este capítulo abordamos el envejecimiento desde el punto de vista de algunos de los modelos empleados para su estudio, que abarcan en orden creciente de complejidad desde seres unicelulares (levaduras) hasta multicelulares llegando al ser humano. (Figura 1).
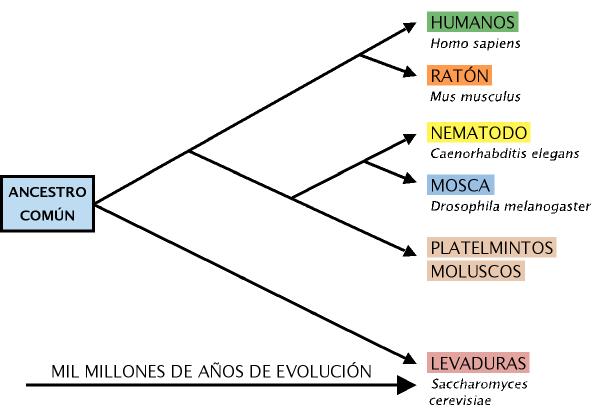
Figura 1. Esquema que representa las diversas líneas evolutivas que han llevado al origen de algunas especies que son empleadas para el análisis de las bases del envejecimiento (adaptado de Guarente y Picard, 2005).
Como ya se ha comentado, el envejecimiento no podemos de forma exclusiva relacionarlo con un gen concreto (monogénico), mas bien es un proceso que implica cambios asociados a la expresión genética de diversos genes (poligénico). Además, la acción del ambiente, entendida en sentido amplio, juega un papel fundamental en la cinética del proceso de envejecimiento. Por esta razón los modelos que veremos para el estudio de este proceso nos sirven en unos casos como ejemplos concretos de la acción de un determinado gen, mientras que otros nos sirven para explicar las acciones de un grupo de genes. Algunos de los genes que se han implicado en el envejecimiento se encuentran muy conservados a lo largo de la escala filogenética, desde las levaduras a los humanos, y a medida que avanzamos en complejidad en dicha escala estos sistemas son más intricados y en consecuencia sus efectos sobre el envejecimiento del organismo en su totalidad se vuelven más difíciles de interpretar. También veremos cómo diversas acciones sobre los organismos vivos (estrés, aporte calórico, etc.) contribuyen a variar los diversos sistemas implicados en el envejecimiento.
Una forma de medir el envejecimiento es calcular la tasa de mortalidad de una población o la probabilidad de que un individuo de esa población muera en un tiempo definido (para las especies longevas, incluyendo los humanos este tiempo es de un año). Para la mayoría de las especies, la tasa de mortalidad se incrementa gradualmente a medida que transcurre la edad del individuo. Esta tasa tiene una representación exponencial y se denomina curva de Gompertz en honor al agente de seguros británico Benjamín Gompertz que en 1825 describió la “ley de la mortalidad” que relaciona el crecimiento exponencial de la mortalidad con la edad. (Figura 2).
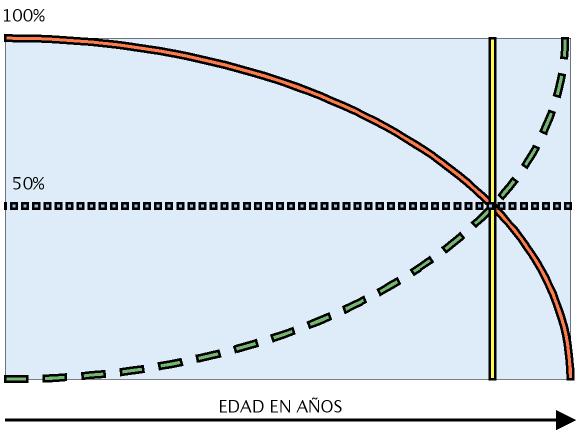
Figura 2. Curvas de Gompertz de supervivencia (continua) y mortalidad (discontinua). A medida que pasa el tiempo se incrementa la mortalidad de una cohorte de individuos (v. gr. personas nacidas hace 120 años) y esa población va disminuyendo en número de forma exponencial (elaboración propia).
Las curvas de Gompertz se emplean para comparar el envejecimiento entre especies y dentro de una misma especie entre poblaciones diferentes, dado que proporcionan una descripción de las tasas de mortalidad aplicable a la mayoría de las poblaciones. En la especie humana la mortalidad empieza a hacerse patente tras la pubertad y continúa incrementándose de forma exponencial con el paso de los años hasta que ningún individuo de una cohorte determinada queda vivo.
Seguidamente analizaremos los modelos más habituales empleados en el estudio del envejecimiento desde levaduras hasta humanos, donde abordaremos las características del envejecimiento en personas centenarias y el estudio de los síndromes progeroides como modelos patológicos de envejecimiento acelerado.
6.2 Envejecimiento en levaduras (Saccharomyces cerevisiae)
Levaduras (reino Fungi, orden Saccharomycetales) es el nombre común de un grupo de hongos unicelulares (eucariotas) del cual la especie más empleada es el Saccharomyces cerevisiae (S. cerevisiae) que crece en forma anaeróbica, aunque puede tener fases aeróbicas, y produce enzimas capaces de descomponer diversos sustratos principalmente los azúcares (fermentación alcohólica). Su rápido ciclo celular, el conocimiento de muchos de sus procesos moleculares y la secuenciación de su genoma (unos 6200 genes), han hecho de este organismo unicelular uno de los modelos más utilizados en diversas áreas de investigación biomédica. La identificación de algunos genes que pueden afectar la cinética de su ciclo vital y su longevidad ha hecho que se comenzara a utilizar la levadura para aproximarse al análisis de las causas del envejecimiento (Longo et al., 1997).
El S. cerevisiae (Figura 3) se reproduce por gemación originando una célula hija con un núcleo del mismo tamaño que el de la célula madre, mientras que su citoplasma deberá pasar por una fase de crecimiento para alcanzar el tamaño de la célula originaria. Cada gemación ocasiona una cicatriz en la membrana de la célula madre y el número de estas cicatrices ha sido un criterio utilizado para “contar” el número de divisiones de una levadura (vida replicativa o reproductiva), pero es de hecho un índice de fecundidad más que de longevidad. Otros criterios para medir la longevidad en levaduras han sido la denominada “supervivencia reproductiva” y “post-reproductiva”.
La supervivencia reproductiva es el tiempo que le lleva a una célula producir su descendencia por gemación, es decir, el tiempo que pasa desde el nacimiento de esa célula hasta la aparición de la última célula hija. Cuantificar la longevidad de una levadura basándonos en la capacidad de proliferación no tiene en cuenta la vida cronológica real, pues en condiciones adversas, las levaduras pueden entrar en una fase estacionaria y mantenerse en dicha fase durante periodos variables, lo cual incrementa la edad cronológica sin variar el número de divisiones (Minois et al., 2005). Durante la vida reproductiva de la levadura se puede contar el número de células hijas que origina (vida replicativa- en condiciones normales se produce una división cada 90 minutos). Este concepto se relaciona con la capacidad proliferativa (número de mitosis – límite de Hayflick) de los fibroblastos. Cada célula resultante (hija) de la división de la célula madre adquiere la capacidad proliferativa que la célula madre tenía en un principio. Es decir, la célula gemada nace con plena capacidad proliferativa, mientras que la célula madre tras la última división entra en fase post-reproductiva (senescencia celular) y, continúa su envejecimiento hasta su muerte.
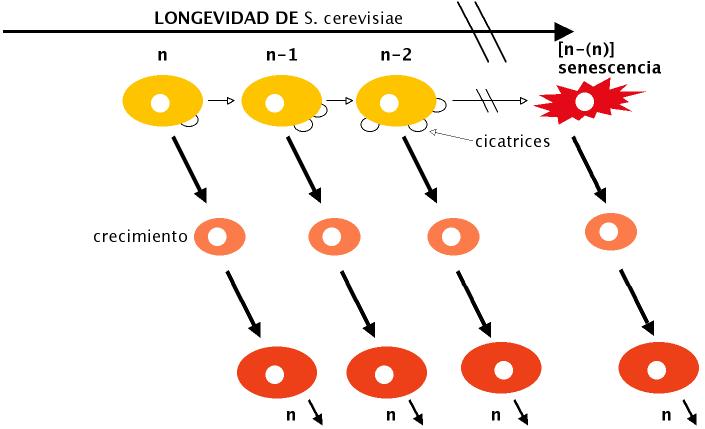
Figura 3. Esquema que muestra la vida replicativa de S. cerevisiae y su vida cronológica. Las dos células resultantes de la mitosis (gemación) son de diferente tamaño, considerándose célula original (madre) la de mayor tamaño citoplasmático y célula hija la de menor tamaño. La célula hija debe crecer en la Fase G1 antes de entrar en fase S (síntesis de ADN). Una célula madre se puede dividir por gemación “n” veces. Cuando llega a “n” divisiones entra en fase de senescencia (vida post-reproductiva) y tras un periodo variable de tiempo muere. Con cada gemación se produce una cicatriz en la célula madre. Cada célula hija resultante, adquiere la capacidad de proliferación total de la célula madre sea cual sea en la gemación que se origina. Así, la célula hija en la última división [n-(n)] adquiere su capacidad proliferativa total (n) (elaboración propia).
La supervivencia post-reproductiva es el tiempo que pasa desde la aparición de la última célula hija por gemación hasta la muerte de la célula madre. La estimación de la longevidad post-reproductiva se realiza utilizando colorantes vitales (phloxina B) que son incorporados y eliminados por las levaduras sanas (son incoloras), mientras que se mantiene en las levaduras en senescencia (toman color). El concepto de supervivencia post-reproductiva se relaciona con la senescencia post-reproductiva vista en los cultivos de fibroblastos (Fase III). Se ha visto que los telómeros no se acortan en las gemaciones de las levaduras, luego el acortamiento de telómeros no es una teoría que pueda explicar la senescencia de estas células, pero la inducción experimental del acortamiento de los telómeros por mutaciones causa la extinción del clon de levaduras (envejecimiento clonal) tras unas 100 divisiones.
6.2.1 Genes implicados en la longevidad de S. cerevisiae
El análisis genético del envejecimiento ha mostrado que más de una veintena de genes juegan un papel determinante en la vida replicativa de la levadura. Estos genes participan en diversos procesos: control metabólico, resistencia al estrés, regulación de la cromatina y estabilidad genética. Además algunos de estos genes tienen funciones en más de uno de estos procesos, lo que sugiere un cierto papel interactivo.
En condiciones normales diversos genes y las proteínas que ellos codifican regulan la capacidad proliferativa (vida replicativa) y la longevidad (vida cronológica) de las levaduras. En este sentido el gen más estudiado es el sir2 que está muy conservado en la escala filogenética (Fig. 1). En S. cerevisiae, sir2 codifica el factor regulador de la cromatina SIR2 (Silencing Information Regulador-2), una deacetilasa de histonas dependiente de NAD que inhibe la recombinación y detiene la transcripción de diversos loci en el genoma. La pérdida de función de sir2 por mutación acorta la vida en S. cerevisiae y, por el contrario, el incremento del número de copias del gen la alarga hasta un 40%, al volver la cromatina a un estado más joven con el consiguiente incremento en la longevidad (Imai et al., 2000). Además como veremos en los siguientes apartados, el incremento de la actividad del gen sirT-1 (un homólogo del sir2) en células de mamíferos se ha visto que reduce la apoptosis inducida por p53 (Cohen et al., 2004).
Como consecuencia del metabolismo se produce un acúmulo gradual de proteínas modificadas por acción oxidativa (estrés oxidativo). En condiciones normales estas proteínas alteradas no son transferidas a la célula hija durante la gemación y permanecen en la célula madre. Esta repartición asimétrica no ocurre en S. cerevisiae deficientes en sir2 y, las proteínas alteradas se distribuyen de forma homogénea por ambas células, lo que sugiere que la deacetilasa SIR2 puede jugar algún papel importante protegiendo a la célula contra las consecuencias del estrés oxidativo (Kaeberlein y Kennedy, 2005). En este sentido se ha observado que la deacetilasa de los mamíferos (SIRT1), homóloga de SIR2 de levaduras, también protege a las células del estrés oxidativo.
La exposición de los organismos a niveles bajos de estrés (hormesis) produce un incremento en la longevidad (Minois, 2000). Entre estos tipos de estrés se encuentran la irradiación, el calor, el frío, la hipergravedad, el ejercicio, la nutrición, etc.). Se ha sugerido que estas situaciones inducen vías celulares (expresión de genes) que tratarían de compensar los efectos negativos de dicho estrés. De esta forma se cree que se induce una respuesta celular controlada que incrementa, de forma indirecta, la longevidad. Se ha propuesto que la base de este incremento de la longevidad vendría determinada por la expresión de genes antiestrés. Cuando los nutrientes (glucosa) del medio de cultivo son escasos, S. cerevisiae utiliza la fosforilación oxidativa para generar ATP en vez de la fermentación. Este cambio altera el metabolismo de la célula reduciendo los niveles del inhibidor de Sir2, la nicotinamida (NA). Como consecuencia de esta desinhibición se sobreexpresa el gen Sir2 que incrementa la longevidad de las levaduras. Por el contrario, cuando se suministra exceso de glucosa al medio de cultivo, la levadura selecciona la vía metabólica de la fermentación, se inhibe la actividad Sir2, se activa la vía Ras2/PKA, y se reduce la longevidad de la levadura. Del mismo modo, la sobre-expresión de la histona deacetilasa SIR2, que es parte de la vía insulina/IGF-1 en C. elegans, extiende la vida en este gusano.
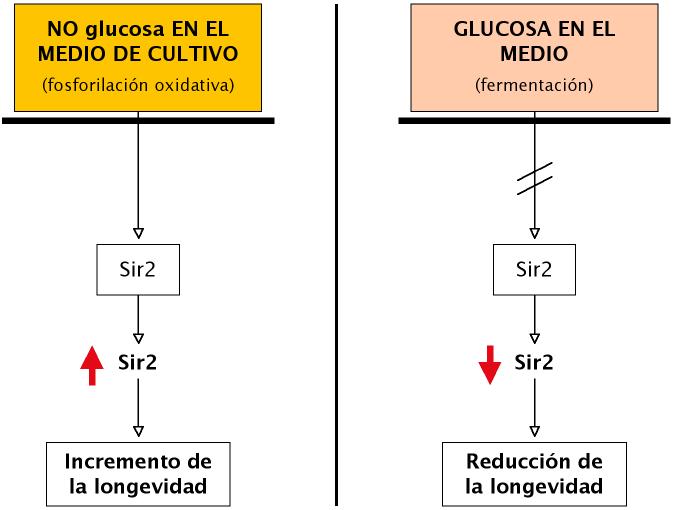
Figura 4. Esquema que muestra la relación entre la ausencia o presencia de glucosa en el medio y la activación o inhibición de Sir2 y el efecto resultante sobre la longevidad en S. cerevisiae (elaboración propia).
Además de sir2, el gen sch9 (homólogo de la proteín-kinasa) controla el crecimiento de las levaduras y sus mutaciones producen levaduras de menor tamaño pero con una extensión de la longevidad frente a las no mutadas (Longo, 2003). Estas dos vías (SIR2 y SCH9) comparten diversas proteínas, superóxido dismutasa y catalasa, que están implicadas en los procesos de detoxificación de radicales libres de oxígeno. El hecho de que la riqueza de nutrientes (glucosa) en el medio induzca una reducción en la longevidad de las levaduras sugiere que la acción de los radicales libres de oxígeno (RLO) generados tiene efectos negativos en la longevidad de S. cerevisiae. Así, se ha observado que más de 600 genes en S. cerevisiae participan en procesos de resistencia y detoxificación de RLO, lo cual representa aproximadamente un 10% del total de genes de dichas células (Temple et al., 2005).
Finalmente, S. cerevisiae posee genes homólogos a algunos humanos, entre los que se encuentra el gen sgs1 cuya mutación produce el acortamiento de la vida de la levadura (Chen y Contreras, 2004). El sgs1 es el homólogo del gen WRN humano, que corresponde a una helicasa que participa en el proceso de reparación del ADN. La mutación del gen WRN causa en humanos el síndrome de Werner (gen WRN, ver síndromes progeroides) que se manifiesta por un fenotipo de envejecimiento prematuro.
6.3 Envejecimiento en nematodos (Caenorhabditis elegans)
El Caenorhabditis elegans (C. elegans) es un nematodo de hábitat terrestre muy utilizado en la investigación biomédica, donde se le conoce como “el gusano” (www. wormbase.org). Entre sus ventajas destacan su fácil manejo (se pueden cultivar en placas de petri), el conocimiento de su genoma (contiene unos 19000 genes), y su reducido número de células (556 al eclosionar y 1090 células el joven de las cuales 131 entran en apoptosis de tal manera que el adulto tiene 959). La mayoría son hermafroditas y ponen unos 300 huevos. Tras un desarrollo embrionario rápido (15 horas), la larva eclosiona y pasa una serie de fases hasta adulto (3 días). Los adultos miden aproximadamente un milímetro de longitud y viven una media de 18-20 días en condiciones de laboratorio (Figura 5). Generalmente la muerte se produce por alteración del sistema muscular (pérdida de sarcómeras), mientras que las neuronas no manifiestan cambios morfológicos asociados al envejecimiento.
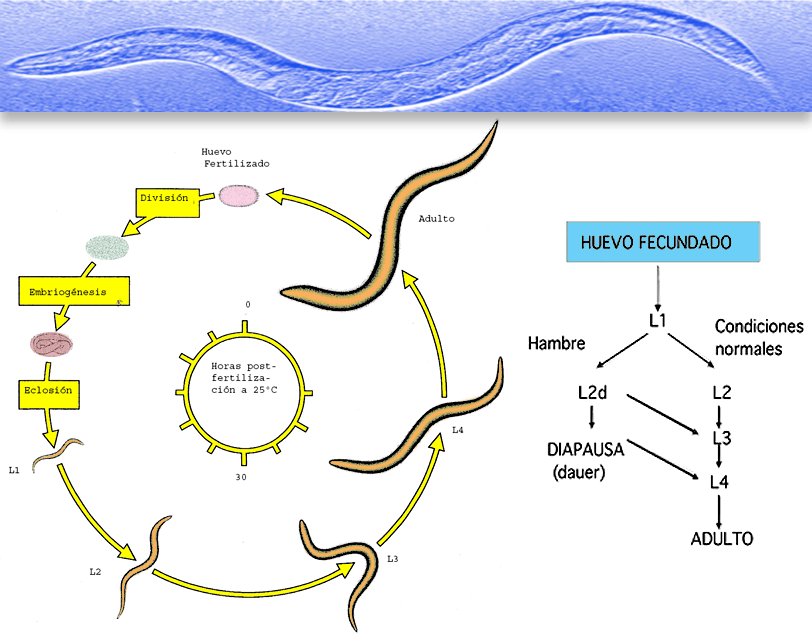
Figura 5. Ciclo vital del nematodo Caenorhabditis elegans. Tras 15 horas post-fertilización se produce la eclosión. La larva al eclosionar tiene 558 núcleos y el adulto 959 núcleos y un número variable de células germinales. Se habla de núcleos pues algunas células forman sincitios. El nematodo adulto tiene una longitud de un milímetro y vive unos 20 días. Cuando las condiciones del medio no son favorables el gusano puede entrar en diapausa y reactivarse su ciclo vital una vez las condiciones vuelven a ser favorables (adaptado de Principles of Development de Lewis Wolpert, 1998).
Una característica interesante de este nematodo es el hecho de que cuando los nutrientes en el medio escasean, existe una sobrepoblación o la temperatura supera los 20ºC entra en diapausa (dauer, letargo) periodo en el cual no se alimenta ni reproduce, pudiendo permanecer en este estado hasta 60 días (Klass y Hirsh, 1976). Como veremos seguidamente se ha podido variar el ciclo vital de C. elegans actuando sobre la posibilidad de inducir cambios en la cinética de entrada en diapausa.
6.3.1 Genes “age”
La primera mutación en un gen que se relacionó de forma fehaciente con un incremento en la longevidad (gerontogén) fue la del gen age-1 en este nematodo (Friedman y Johnson, 1988), y supuso el comienzo de la biogerontología molecular. Este gen muestra algunas de las características del antagonismo pleiotrópico (ver capítulo 1) pues los nematodos (con algunos alelos de este gen) viven más tiempo pero producen una menor descendencia. Así, uno de los alelos del age-1 (hx546) incrementa la vida media del adulto un 65 % y la longevidad hasta un 105 %. En una comparación con nematodos salvajes, los que poseían el alelo hx546 ponían un 75% menos de huevos (72 vs. 317). Una característica de este alelo es el hecho de que incrementa la fase postreproductiva (L4) del gusano no afectando la cinética de las fases previas. Así, sólo la parte final de su ciclo vital está prolongado. Se ha visto que las características fundamentales de los nematodos con mutaciones age-1 son resistentes al H2O2, luz UV y presentan una reducción de las deleciones en el ADNmt.
6.3.2 Genes “daf” (dauer larva abnormal formation)
Al hallazgo del gen age-1 se unió poco después el descubrimiento de que una mutación en el gen daf-2 (el homólogo del receptor insulina/IGF-1, insulin-growth factor-1) también incrementaba la longevidad en los gusanos pudiendo llegar a vivir hasta 60 días (Kenyon et al., 1993). Estos genes daf que regulan la decisión de progresar hacia un desarrollo normal o entrar en diapausa han sido objeto de intensos estudios. Ligeras mutaciones en los genes daf permiten a estos animales convertirse en adultos y vivir al menos el doble de su ciclo vital normal. Este hecho se ha puesto de manifiesto cultivado larvas de C. elegans (mutantes daf-2, alelo e1370) a 15ºC y una vez pasada la fase en la cual pueden entrar en diapausa (L2) se eleva la temperatura a 20ºC. Se ha visto que los adultos así inducidos incrementan su longevidad pero reducen su fertilidad, poniendo una media de 212 huevos frente a los 278 de los nematodos salvajes.
Entre los genes daf identificados (además de daf-2) destaca daf-16, que puede acortar o alargar la vida de este gusano mediante un complejo mecanismo de reacciones en cascada en las que están implicadas, entre otras moléculas, la insulina y la glucosa. Si la proteína DAF-16 (factor transcripcional) se encuentra en el citoplasma de las células (se denomina posición “off”) es inactiva. Si la proteína DAF-16 se traslada al núcleo (posición “on”) se dispara la cadena de acontecimientos que llevan al animal a aumentar significativamente su longevidad. En posición "on", DAF-16 se acumula en el núcleo de muchos tipos celulares y afecta a las actividades de genes implicados en el metabolismo y la respuesta al estrés, incluyendo la capacidad de detoxificar RLO. Se ha sugerido que éste pudiera ser el mecanismo que subyace al incremento de la longevidad. De forma contraria, si DAF-16 está localizada en el citoplasma ("off"), el resultado es un acortamiento de la vida por una menor actividad en los sistemas de reparación del daño celular.
El paso “off-on”, parece estar controlado, no sólo, por la necesidad de nutrientes, sino también por otras condiciones ambientales, como la temperatura y el estrés, de manera parecida a como actúa en los mamíferos (ver más adelante), que también tienen la proteína DAF-16. De hecho, en humanos, la insulina liberada por el incremento de la glucosa hace que DAF-16 permanezca en el citoplasma (off). Estos hallazgos demuestran que hasta cierto punto, la longevidad en C. elegans está sujeta a regulación hormonal y por tanto es probable que este mecanismo de inducción-activación de DAF-16 sea similar en los mamíferos (Kenyon et al., 1993).
6.3.3 Genes “clk” (clock abnormal biological timing)
Otro sistema que opera en la longevidad en nematodos implica los genes clk, así llamados por que regulan los relojes (clock) fisiológicos, del desarrollo y del comportamiento durante su ciclo vital. Se han identificado cuatro mutantes clk que muestran un moderado incremento en la longevidad. La proteína CLK-1 se localiza en las mitocondrias de todas las células somáticas del “gusano” y es necesaria para la biosíntesis de la coenzima Q (CoQ). La CoQ juega un importante papel en la cadena de transporte de electrones de la mitocondria y los mutantes para clk-1 la adquieren nutriéndose de E. coli (ricos en CoQ). La retirada del CoQ de la dieta de los nematodos salvajes alarga la vida adulta un 60%, probablemente por la disminución en la generación de RLO por la mitocondria al reducir el ritmo metabólico y el daño molecular debido al estrés oxidativo (Rodríguez-Aguilera et al., 2005).
6.3.4 Genes “old” (overexpresion longevity determinants)
El gen de la longevEl gen de la longevidad que codifica la OLD-1 (una tirosina kinasa transmembrana) se induce por el estrés y su expresión incrementa la longevidad. La expresión de old-1 parece dependiente de DAF-16 y es necesaria para la extensión de la vida de los mutantes age-1 y daf-2. Asimismo, la expresión del HSF-1 (factor de reacción al estrés por calor) incrementa la longevidad un 20%, independientemente de DAF-16.
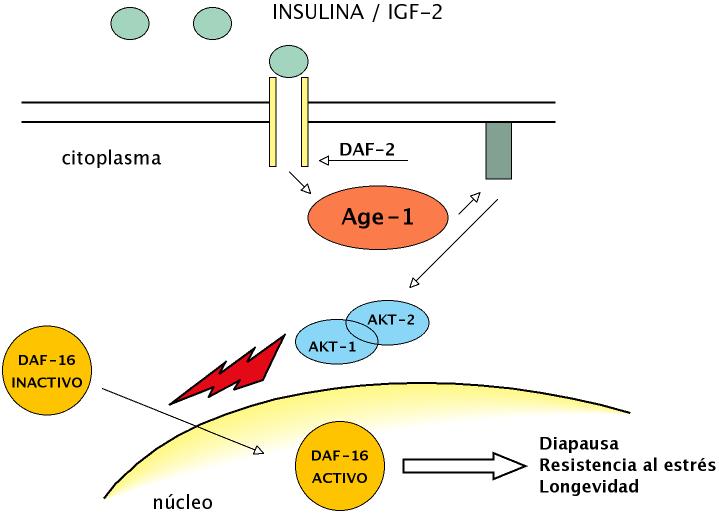
Figura 6. El descubrimiento más significativo del envejecimiento en invertebrados ha sido la demostración del papel que juega en este proceso la vía insulina/IGF-1 (IIS). En C. elegans, esta vía de señalización se inicia con la síntesis del producto del gen daf-2 que es un receptor para la insulina/IGF-1. En respuesta a la activación del receptor se activa una proteína intracelular llamada AGE-1 que activa un sistema de segundos mensajeros (las kinasas PDK-1, AKT-1 y AKT-2). Estas kinasas permiten el paso del DAF-16 del citoplasma (estado inactivo off) al núcleo (estado activo on), incrementando, entre otras actividades, la resistencia al estrés y la longevidad (adaptado de Principles of Development de Lewis Wolpert, 1998).
6.3.5 Genes “sir”
Como hemos visto anteriormente, el punto de convergencia de las vías de la longevidad y las funcionales para el mantenimiento somático se ha puesto de manifiesto con el descubrimiento de sir-2, un gen implicado en la longevidad del nematodo. SIR-2 (silencing information regulador 2) es una histona deacetilasa dependiente de NAD cuya función es silenciar el ADNr. Tissenbaum y Guarente (2001) demostraron que una dosis extra de sir-2 en nematodos extiende la vida adulta un 50% por su acción en la regulación de la vía de señalización de la insulina que afecta algunos aspectos del metabolismo energético y de la respuesta al estrés.
El hecho de que la levadura y el C. elegans divergieron de un ancestro común hace mil millones de años (Figura 1) sugiere que todos los descendientes de ese ancestro común, incluyendo los mamíferos, pudieran poseer genes relacionados con sir-2 implicados en la regulación de la longevidad. La mayoría de los 40 genes mutantes en C. elegans que cursan con un incremento en la longevidad, aumentan la capacidad del gusano para responder a ciertos tipos de estrés (calor, radiación ultravioleta y RLO). En este sentido, la capacidad pro-longevidad de la restricción calórica (RC), un mecanismo que extiende la vida en múltiples especies desde la levadura a los mamíferos, se pierde en ausencia de SIR-2. Como ya hemos comentado, las mutaciones en un solo gen pueden incrementar la longevidad en C. elegans cuando afectan a la vía insulina-factor de crecimiento de insulina (IGF) (Kenyon, 2001). Estos hallazgos hicieron que comenzara a efectuarse manipulaciones de los genes homólogos en moscas y finalmente en roedores (ratones) como modelos de mamíferos. Pasaremos seguidamente a analizar la Drosófila como un modelo más complejo de envejecimiento.
6.4 Envejecimiento en insectos
6.4.1 La mosca de la fruta (Drosophila melanogaster)
La Drofósila es un animal muy apropiado para realizar estudios de envejecimiento por ser un organismo de pequeño tamaño, fácil de mantener y de ciclo vital breve (aproximadamente dos meses). Existe un gran conocimiento de su desarrollo, biología y su genoma está secuenciado (unos 13600 genes). Además, un número muy importante de sus genes presentan homólogos en la especie humana. Una característica es que los animales adultos están formados fundamentalmente por células que no se dividen (postmitóticas) y el envejecimiento se produce, fundamentalmente, por desgaste y falta de reparación de los elementos dañados (senescencia mecánica).
Figura 7. Drosófilas macho (izquierda) y hembra (derecha). Reino animal. Filo artrópodo. Clase insecto. Orden díptero. Las drosófilas no desarrollan tumores, pues en su metamorfosis (pupa) se originan con todas sus células postmitóticas. Del mismo modo la mayoría de las lesiones en su cutícula no se reparan y causan su muerte (senescencia mecánica) (autor desconocido).
La Drosófila ha sido muy utilizada para estudios de longevidad y genética del envejecimiento en poblaciones no seleccionadas genéticamente (wild-type, salvajes). Uno de los primeros experimentos destinados probar la posible existencia de una base evolutiva del envejecimiento se realizó en moscas. Clare y Luckinbill (1985) observaron que aquellas poblaciones que vivían hacinadas, con un elevado número de larvas compitiendo entre si por escasos recursos de alimentación, retrasaban su reproducción y la longevidad de los adultos se incrementaba hasta un 50% cuando se comparaba con poblaciones no hacinadas. Este experimento mostró la existencia de una fuerte influencia del ambiente en la expresión de un determinado tipo de longevidad. Posteriormente se demostró que este incremento implicaba la coordinación de la expresión de genes para la síntesis de enzimas de defensa antioxidante (SOD), aumentando de esta forma la resistencia al estrés oxidativo y reduciendo los niveles de daño oxidativo en las proteínas y lípidos celulares (Arking, 2002).
Además de SIR-2 otra deacetilasa de histonas, RPD-3, se ha visto que participa en la extensión de la longevidad en Drosófila. Ambas deacetilasas regulan de forma opuesta el estado de la compactación del nucleosoma contribuyendo de esta manera al silenciamiento o la expresión de algunos genes. SIR-2 reduce la deacetilación y RPD-3 la incrementa. La sobreexpresión de Sir-2 y su activación por compuestos polifenólicos extiende la longevidad en nematodos, levaduras y moscas. En mamiferos las proteínas SIR pueden deacetilar algunas proteínas reguladoras y el factor de trascripción FOXO. Al igual que en levaduras y nematodos, la reducción en la señalización de la vía insulina/IGF-1 en Drosófila regula la longevidad. Algunas mutaciones en los genes de la mosca que codifican la síntesis del homólogo del receptor insulina/IGF-1 incrementan la longevidad de las hembras aproximadamente un 45%.
Finalmente, pérdidas parciales en la función por mutación de algunos genes que incrementan la longevidad han sido descritas en moscas y debido a este efecto se denominaron “matusalén” (methuselah, mth) y “yo aún no estoy muerta” (I’m not dead yet, Indy). El gen Mth codifica una proteína G transmembrana que debido a sus características se ha sugerido que actúa como un receptor. Los mutantes de Mth muestran un incremento en la resistencia al calor y al estrés oxidativo. Por otra parte, el gen Indy codifica una proteína implicada en el metabolismo (tranportador dicarboxilato) y su mutación parece incrementar la longevidad por acción en el metabolismo celular. Ambas mutaciones incrementan la longevidad en la mosca un 30 y un 100% respectivamente y a diferencia de lo que sucedió con el receptor de insulina, este incremento se produce tanto en machos como en hembras y sin afectar a la fertilidad de estos insectos (Lin et al., 1998).
6.4.2 Insectos sociales (Apis mellifera)
Un ejemplo del control del ambiente sobre el envejecimiento se observa en algunos insectos sociales en los cuales las diferentes castas pueden tener diferentes esperanzas de vida aunque todos los individuos tienen los mismos genes. En el caso de la abeja de la miel (Apis mellifera) los machos haploides (zánganos), las hembras (obreras) y las reinas se desarrollan a partir del mismo genoma tras 24, 21 y 16 días de incubación respectivamente. Desde el punto de vista de la longevidad, los zánganos viven 60 días, una reina puede vivir 5 años y una obrera entre 40-140 días dependiendo de la estación del año en la cual eclosionen. Las diferencias en la longevidad entre zánganos, obreras y reinas, al menos en parte, se pueden atribuir a diferencias en la mortalidad extrínseca asociada a los riesgos de las diferentes tareas de cada grupo. Mientras que la reina permanece en la colmena libre de predadores externos, las obreras y zánganos están sometidas a peligros y predadores externos.
La larva destinada a reina recibe grandes cantidades de alimentos (jalea real) que estimulan la secreción de hormonas juveniles. Si estos nutrientes no son suministrados durante un periodo crítico del desarrollo, los ovarios degeneran y la abeja se desarrolla hacia un insecto estéril, pero genéticamente hembra y obrera (Ruppell et al., 2004). La reina vuela una sola vez y durante su vuelo nupcial realizado poco después de llegar a adulta es fecundada por un zángano, adquiriendo esperma que almacena en su tracto reproductor durante toda su vida fértil. La reina sufre cambios morfológicos y funcionales destinados a asegurar la reproducción y aunque pone numerosos huevos al día, no muestra signos de envejecimiento durante su etapa fértil. A diferencia de las otras castas (zánganos y obreras), la reina sí posee células con capacidad proliferativa que la permiten reparar ciertos órganos (intestino, etc.). Cuando finaliza su etapa reproductora la reina es eliminada por las obreras de la colonia.
La población obrera desde el punto de vista de la longevidad y del envejecimiento muestra una característica muy interesante. Las obreras que salen de los huevos en primavera o principios de verano y viven unos 2 meses, de los cuales dos tercios los emplean como obreras del panal (realizando allí sus funciones), transformándose posteriormente en recolectoras externas (sometidas a la acción de predadores). Por su parte, las abejas de invierno eclosionan cuando las fuentes de néctar y polen son escasas y viven hasta tres veces más que las que eclosionan en primavera (6-8 meses). Las abejas de invierno se diferencias de las de verano en diversos aspectos fisiológicos relacionados con la diferente disponibilidad de recursos. Se ha propuesto que esta restricción calórica (RC) ocasionada por la poca disponibilidad de recursos en el invierno determina un incremento de la longevidad (Amdam et al., 2004).
6.5 Envejecimiento en peces, reptiles y aves
En estos grupos de animales se encuentran algunos de los ejemplos más significativos de las características especiales de algunos tipos de envejecimiento y longevidad. Los animales marinos no han sido muy utilizados para el análisis de los procesos de envejecimiento aunque en los últimos años un grupo de ellos se han usado como modelos para el estudio de determinadas características de este proceso. El envejecimiento en los peces muestra las características generales observadas en especies terrestres es decir, en términos generales, suele ser un proceso gradual.
En los peces viejos se ha observado la acumulación de lipofuscina en las células del sistema nervioso, peroxidación de lípidos, puentes de colágeno, etc., lo cual va originando una reducción en la capacidad funcional de diversos órganos.
Los animales semélparos se reproducen una sola vez (semelparidad: semel una vez; pario, engendrar). En este grupo se encuentra, entre otros, el salmón del pacífico que tiene una longevidad de aproximadamente 4 años (Oncorhynchus nerka) y momentos después de haber procedido a su reproducción (freza) inicia un proceso de envejecimiento acelerado y muerte a los pocos días. Este proceso postreproductivo se caracteriza por una elevación de los niveles de hormonas esteroideas (cortisol) que inducen la rápida degeneración de diversas glándulas y órganos de la economía (v. gr. tiroides, hipófisis, riñones, estómago, etc.), lo que ocasiona la muerte por fallo multiorgánico. La administración exógena de hormonas esteroideas a salmones jóvenes ocasiona esta cascada de procesos que finalizan con la muerte.
De forma semejante a lo descrito para los peces, también en los reptiles se observan las características del envejecimiento, siendo una excepción las tortugas y los cocodrilos que crecen durante toda su vida, es decir tienen un periodo de crecimiento igual a su longevidad y se considera que el periodo de envejecimiento es casi inexistente. Es en este grupo de animales donde se encuentran algunas de las especias más longevas como las tortugas de las Islas Galápagos (hasta 150 años). Se ha propuesto que la longevidad de estos reptiles está ligada a la capacidad de sus células para producir pocos RLO y detoxificar rápidamente aquellos que se hubieran formado (Lutz et al., 2003).
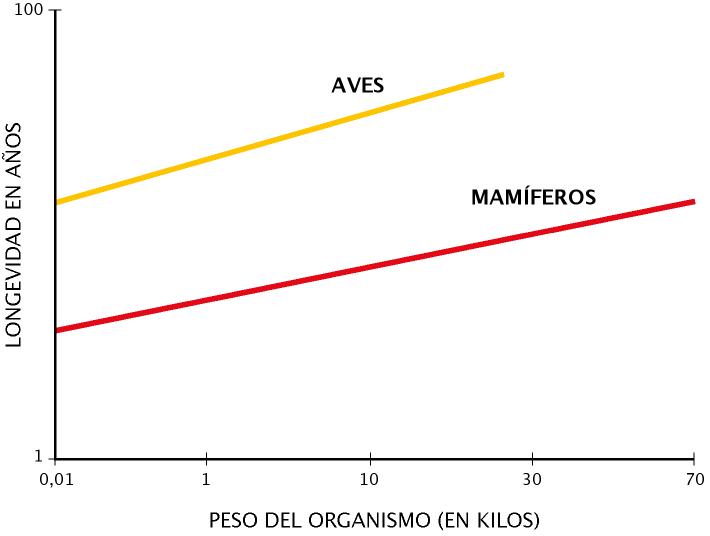
Figura 8. Se muestra la diferencia de longevidad entre aves y mamíferos cuando se comparan según sus pesos corporales (adaptado de Barja, 2002).
Las aves son por lo general animales muy longevos en comparación con los mamíferos, mostrando mayor longevidad a igualdad de peso (Figura 8). Otra característica es que aunque consumen grandes cantidades de oxígeno no producen muchos RLO y, debido posiblemente a la baja tasa de formación de estos tóxicos, sus células poseen pocos antioxidantes endógenos (Barja, 2002).
6.6 Envejecimiento en ratón (Mus musculus)
Uno de los modelos más utilizados para el estudio del envejecimiento entre los mamíferos es el ratón (Figura 8) del cual se conocen en la actualidad numerosas características de su biología incluido su genoma. El zigoto se deposita en el útero tras 5 días postfertilización y tiene un periodo de gestación de 20 días, alcanzando la madurez a las 6 semanas de vida postnatal. La longevidad es variable, dependiendo de las cepas, pero raramente supera los tres años. Este relativamente corto ciclo vital le ha convertido en un modelo muy utilizado en investigación biogerontológica.

Figura 9. Ratón (Mus musculus) es un múrido muy utilizado en investigación. Los adultos tienen un peso entre 15-30 gramos y una longitud entre 15-20 centímetros. Su ciclo vital no suele superar los dos años en la vida salvaje y tres años en condiciones de laboratorio (autor desconocido).
En este apartado nos vamos a centrar en los modelos de ratones mutantes que han mostrado importantes incrementos en longevidad comparados con los no seleccionados (wildtype o salvajes), que actúan como controles. Finalmente analizaremos un modelo de ratón de envejecimiento acelerado.
6.6.1 Ratones enanos (Dwarf mice, DM)
Existen varias cepas de ratones enanos (Snell, Ames, y little mouse.) que además presentan un incremento de la longevidad. A continuación analizaremos más profundamente a continuación:
Snell (1929) fue el primero en describir una cepa de ratones con mutaciones recesivas que cursan con enanismo. Los ratones Snell presentan una mutación puntual en el gen Pit-1 (pituitary-specific transcription factor 1), que controla el desarrollo de la hipófisis. En estos ratones, la longevidad está incrementada un 40% respecto de los controles. Posteriormente, Schailable y Gowen (1961) describieron otro ratón con una mutación recesiva que producía también un enanismo hereditario: el ratón enano Ames, con mutaciones puntuales en el gen Prop-1 (df). Este gen es necesario para la activación de Pit-1 y su pérdida provoca que esta cepa viva entre el 50-70% más que los controles (Brown-Borg et al., 1996).
Estas dos mutaciones (Pit-1 y Prop-1) cursan con un hipopituitarismo funcional que afecta, entre otras, a la hormona de crecimiento (GH), prolactina y hormonas gonadotropas. Además estos ratones tienen alteraciones en la cascada de señalización de la vía de la insulina/IGF-1, que se ha sugerido pudiera ser el factor clave en la extensión de la longevidad, ya que presentan unos niveles plasmáticos de insulina, IGF-1 y glucosa más bajos que los controles.
Otro modelo murino enano de extrema longevidad es el ratón pequeño (little mouse). Estos ratones tienen una mutación en el gen Ghrhr (receptor de la hormona de liberación de la GH) (Godfrey et al., 1993), y como consecuencia de ello, los niveles de GH descienden al 1% y los de IGF-1 al 9-23% respecto del control. Los ratones homozigóticos Ghrhrlit/lit viven más (23%) que los heterozigóticos Ghrhr+/lit. Por el contrario, los ratones transgénicos para GH tienen una longevidad reducida. Estos resultados sugieren que los cambios en el eje GH/IGF-1 pueden ser suficientes, al menos en ratones, para incrementar la longevidad.
6.6.2 Ratón knockout para la proteína de unión al receptor de la hormona de crecimiento (GHR/BP knockout mice)
El gen humano y murino GHR/BP codifica dos proteínas: el receptor de la GH (GHR) y la proteína de unión al receptor (BP) de la GH, que es un péptido más corto que el receptor. En humanos, la mutación de este gen causa el síndrome de Laron que es un enanismo hereditario. El ratón knockout para este gen GHR/BP-/- presenta un desarrollo normal hasta la cuarta semana, pero alcanzada esta edad muestra un severo déficit en el desarrollo. Estos ratones poseen unos niveles muy elevados de GH (hasta 10 veces más que los controles) y niveles muy bajos de IGF-1 (menos del 90% de los controles). Desde el punto de vista de la longevidad, se ha visto que los ratones GHR/BP-/- viven un 50% más que los GHR/BP+/- y que los controles (Coschinago et al., 2003).
6.6.3 Ratón knockout para p66shc
En mamíferos, el locus Shc codifica tres isoformas de la misma proteína (p52, p46 y p66). La proteína p66shc tiene dos funciones fundamentales. Una es su función de transductor de señales citoplasmáticas transmitiendo señales mitóticas y otra es su papel en respuesta a determinados tipos de estrés celular. En este sentido, p66shc es activada por la p53, siendo indispensable para que esta induzca apoptosis por la formación de RLO. La SIRT1 humana y su ortóloga la Sir2a en ratón puede unirse a p53 y deacetilarla tanto in vitro como in vivo, promoviendo de esta manera la longevidad celular por la represión especifica de la respuesta apoptótica dependiente de p53. Esto respaldaría la relación entre muerte celular dependiente de p53 y envejecimiento (Trinei et al., 2002).
La característica más interesante de los ratones homocigóticos (p66shc-/-) es su gran resistencia al estrés oxidativo y a la radiación con luz UV. Además tienen una media de incremento de la longevidad de 40% respecto a los controles. La formación de RLO en estos ratones se ha visto que está reducida en un 50%, y la peroxidación de lípidos en un 35%, lo que demuestra un efecto protector de esta mutación frente a la producción de RLO y sus efectos en las células de estos ratones. Los ratones p66shc-/- viven una media de 973 días, los p66shc+/- una media de 815 y los controles 761 días (Migliaccio et al., 1999). En relación con el envejecimiento humano debemos señalar que un reciente estudio (Pandolfi et al., 2005) ha mostrado que los fibroblastos de las personas centenarias expresan niveles elevados de la proteína p66shc.
6.6.4 Ratón knockout para el receptor del factor tipo I de insulina (IGF-1R)
El ratón knockout para el receptor del factor de crecimiento tipo insulina, IGF-1R (Igf1r-/-) no es viable y muere al nacer debido a fallo respiratorio. Por otra parte el ratón Igf1r+/- de ambos sexos crece normalmente hasta el destete pero posteriormente muestra un ligero retraso en su desarrollo. Estos ratones presentan gran resistencia al estrés oxidativo y su longevidad es un 33% superior en las hembras y un 16% en los machos frente a los controles.
6.6.5 Ratón knockout para el receptor de insulina específico de grasa (fat-specific insulin receptor knockout, FIRKO)
El ratón mutante de FIRKO se caracteriza por presentar una reducción del 85-90% en el número de receptores para la insulina (IR) en el tejido adiposo, pero su número es normal en el resto de tejidos de la economía. Esta deficiencia determina que la captación de glucosa por los adipocitos esté reducida en torno al 90%. El ratón FIRKO tiene un peso inferior al normal (20%) aunque su ingesta calórica sea superior a los controles, y su masa grasa es sólo del 50-70% de los controles. Los niveles plasmáticos de insulina también son inferiores a los controles (35%) aunque mantienen una glucemia en valores normales. Cuando estos ratones envejecen siguen manteniendo una curva de tolerancia a la glucosa normal mientras que los controles presentan intolerancia por resistencia a la insulina. La esperanza de vida de los ratones FIRKO es superior a los controles (18%) y la longevidad máxima fue de 40 meses (ver Tabla 1).
Para demostrar si la inactivación específica en el cerebro del gen IGF-1R puede conducir a un incremento de la longevidad en el ratón se produjo el ratón Cre (mutante condicional) para el IGF-1R en el sistema nervioso central (SNC). Estos mutantes que son genéticamente hiposensibles a IGF-1R en el SNC tienen un incremento de la longevidad. Estos estudios aportan nuevos conocimientos sobre la importancia de la regulación neuro-endocrina de la longevidad. Las cifras de longevidad de ésta y las otras cepas mencionadas aparecen en la Tabla 1.
|
MODELOS DE RATONES |
LONGEVIDAD (DIAS)A |
PESOB (% de controles) |
|||
|
Mutante |
Background genético |
Controles |
Mutante |
% incremento |
|
|
Ratón Enano Ames |
Ames |
|
33 |
||
|
- Hembras
- Machos |
718 ± 45
723 ± 54 |
1206 ± 32
1076 ± 56 |
68
49 |
|
|
|
Ratón Enano Snell |
Pit1dw |
|
33 |
||
|
- Hembras
- Machos |
811 ± 20
822 ± 34 |
1148 ± 39
1037 ± 53 |
42
26 |
|
|
|
Ghrhrlit/lit |
C57BL/6 |
|
67 |
||
|
- Hembras
- Machos |
857 ± 169
886 ± 148 |
1070 ± 127
1093 ± 186 |
25
23 |
|
|
|
GHR/BP-/- |
129Ola X BalbC |
|
40 |
||
|
- Hembras
- Machos |
749 ± 41
629 ± 72 |
1031 ± 41
975 ± 106 |
38
55 |
|
|
|
GHR/BP-/- |
C57BL/6 |
|
41 |
||
|
- Hembras
- Machos |
821 ± 49
756 ± 68 |
956 ± 80
951 ± 50 |
16
26 |
|
|
|
p66shc-/- |
129/Sv |
|
100 |
||
|
- Sexo no indicado |
761±191 |
973±37 |
30 |
|
|
|
Igf1r+/- |
129/Sv |
|
92-94 |
||
|
- Hembras |
568 ± 49 |
756 ± 46 |
33 |
||
|
FIRKO |
129/Sv X C57B1/6 |
|
75-85 |
||
|
- Ambos sexos |
753 |
887 |
18 |
||
Tabla 1. Se muestran las características de algunas de las cepas de ratones que presentan una longevidad incrementada. A = media ± error estándar de la media, B= Peso de los ratones a los 10 meses de edad (adaptado de Liang et al., 2003).
Hay 7 homólogos del SIR2 de levaduras en mamíferos, pero la más relacionada es SIRT1 que se ha demostrado reprime en mamíferos FOXO3a, un homólogo de DAF16. FOXO3a protege a las células de mamíferos frente al estrés oxidativo estimulando tanto la reparación del ADN como las actividades de defensa antioxidante. SIRT1, induce la parada del ciclo celular, inhibe la inducción de muerte celular (apoptosis) e incrementa la resistencia al estrés oxidativo.
Los datos sobre los efectos de la deficiencia de GH y IGF-1 sobre la longevidad son discutidos. El hecho de que los ratones enanos tengan una longevidad mayor que los controles ha iniciado una etapa de gran controversia sobre los efectos de la administración de esta hormona de forma exógena. Si la deficiencia en GH es congénita (los pacientes con múltiples deficiencias hormonales hipofisarias debido a mutaciones en el gen Prop-1), y en los pacientes con deficiencia aislada de IGF-1 por mutaciones en el gen del receptor GH (síndrome de Laron), a pesar de los signos de envejecimiento temprano (piel arrugada, obesidad, resistencia a la insulina y osteopenia), la longevidad alcanza los 80-90 años. Por otra parte, si las alteraciones aparecen más tardíamente y las personas liberan cantidades elevadas de GH en la etapa joven-adulta (acromegalia) la esperanza de vida es menor. Estos datos han abierto la discusión sobre si la administración farmacológica de GH en adultos es beneficiosa en contra de las opiniones que animan a su uso tanto en personas afectas de hipopituitarismo como en tratamientos no controlados (Laron, 2005). A este respecto se ha sugerido que la GH pudiera tener un efecto beneficioso a corto plazo pero que un incremento crónico de GH/IGF-1 incrementaría la morbilidad y la mortalidad. En resumen, los resultados en modelos de ratones para extender la longevidad sugieren que la disminución de las señales insulina y el consiguiente modulación de la actividad de las proteínas relacionadas posiblemente en combinación con la atenuación de la actividad p53 es también un mecanismo fundamental para incrementar la longevidad y posponer el envejecimiento por la degeneración asociada.
6.6.6 Modelos de ratones de envejecimiento acelerado
En el ratón se ha producido recientemente un enorme incremento en la búsqueda de modelos de envejecimiento acelerado. Esto ha originado la aparición de animales genéticamente modificados que presentan mutaciones específicas que inducen un envejecimiento acelerado. La mayoría de estas mutaciones implican alteraciones en los procesos de reparación del ADN y generalmente afectan a vías metabólicas que inducen un incremento del daño oxidativo por la acción de RLO. Estas alteraciones conducen a la falta de reparación de las mutaciones genéticas, la inhibición de la trascripción y un incremento de la apoptosis. Estos hallazgos están en relación con algunos síndromes humanos que muestran múltiples síntomas de envejecimiento acelerado como los denominados síndromes progeroides. De manera interesante, en un modelo murino la hiperactividad de la p53 causa una sobreexpreión de p44 se produce envejecimiento acelerado.
|
ANIMAL |
GESTACION1 |
VIDA MEDIA2 |
LONGEVIDAD3 |
|
ALCE |
250 |
15 |
26:6 |
|
ARDILLA |
31 |
6 |
8 |
|
ASNO |
365 |
12 |
35:10 |
|
BABUINO |
187 |
20 |
35:7 |
|
CABALLO |
330 |
20 |
46 |
|
CONEJO |
31 |
5 |
13 |
|
CAMELLO |
406 |
12 |
29:5 |
|
CASTOR |
122 |
5 |
20:6 |
|
CERDO |
112 |
10 |
27 |
|
CHIMPANCÉ |
231 |
20 |
44:6 |
|
CIERVO |
201 |
8 |
17:6 |
|
ELEFANTE (ASIÁTICO) |
645 |
40 |
70 |
|
GALLINA |
22 |
7 |
14 |
|
GATO |
63 |
12 |
28 |
|
GORILA |
257 |
20 |
39:4 |
|
HAMSTER (DORADO) |
16 |
2 |
8 |
|
JIRAFA |
425 |
10 |
33:7 |
|
LEÓN |
100 |
15 |
25:1 |
|
LEÓN MARINO |
350 |
12 |
28 |
|
LEOPARDO |
98 |
12 |
19:4 |
|
LOBO |
60 |
11 |
16 |
|
OVEJA |
154 |
12 |
20 |
|
OSO POLAR |
240 |
20 |
34:8 |
|
PATO |
28 |
10 |
15 |
|
PERIQUITO |
18 |
8 |
12 |
|
PERRO |
61 |
12 |
20 |
|
RATA |
21 |
3 |
5 |
|
RATÓN (DOMÉSTICO) |
19 |
3 |
3:6 |
|
TIGRE |
105 |
16 |
26:3 |
|
VACA |
284 |
15 |
30 |
|
ZORRO |
52 |
7 |
14 |
|
(1) días, (2) años y (3) años:meses. |
|||
Tabla 2. Se muestran los periodos de gestación, años de vida (media) y longevidad de diversas especies de mamíferos y aves. Las teorías basadas en la evolución, proponen que la longevidad correlaciona con la duración de la gestación (incubación) y el tiempo destinado al cuidado de la descendencia. Las especies que tienen periodos largos de gestación y pocos descendientes viven más que las que tienen periodos cortos y muchos descendientes. En términos generales se puede decir que se invierte en descendencia y se pierde en longevidad al dedicar pocos esfuerzos a la reparación de las lesiones celulares y más a la reproducción (elaboración propia).
En el modelo de ratón trasgénico para p44, el envejecimiento acelerado está acompañado de una activación del eje IGF-1. La sobrexpresión de la proteína p44, una isoforma corta de la p53, ha revelado de forma inesperada el papel de la p53 en la regulación de la longevidad de los ratones (Maier et al., 2004). La hiperactivación del eje insulina/IGF por la p44 pone en acción una cascada de kinasas que sugiere una vía de acción común en la regulación de la longevidad en animales inferiores y mamíferos vía p53 por medio del control de la proliferación. En consecuencia, la apropiada supresión de la p53 y su isoforma corta p44 permitiría mantener un balance entre la supresión de tumores y la regeneración celular un requisito fundamental en la longevidad de los mamíferos. También los signos (fenotipo) del envejecimiento acelerado se han observado en ratones con defectos genéticos en genes implicados en el mantenimiento del genoma, tales como el gen que repara la escisión de nucleótidos (Xpd) y el que repara la rotura de la doble hélice (Ku80).
Finalmente el ratón SAM (senescence-accelerated mouse) es un modelo murino de envejecimiento acelerado (longevidad máxima 14 meses) causado únicamente por un depósito generalizado de amiloide en todos los órganos de la economía excepto en el cerebro. Este modelo presenta la ventaja de que no se han encontrado mutaciones que induzcan un acortamiento de su ciclo vital siendo el continuo depósito de amiloide el único parámetro que se encuentra alterado. Existen varias cepas de ratones SAM que muestran patrones de envejecimiento específicos en diversos órganos y sistemas (Takeda, 1999). En la tabla 2 aparecen algunos datos sobre la duración de la gestación y la longevidad en diversas especies.
6.7 Envejecimiento en humanos
6.7.1 Envejecimiento en centenarios
La mayoría de las personas que superan los 100 años viven su extraordinaria longevidad con una salud que podemos considerar muy aceptable y es sólo en los últimos años de su vida o cerca de su final cuando esta presenta un rápido declive. El estudio de las peculiaridades que presentan las personas centenarias ha abierto un campo de investigación muy importante en el área de la biogerontología por los conocimientos que dichos estudios pueden aportar. No sólo es importante el estudio de las bases genéticas del envejecimiento sino que el estudio del ambiente y sus características están también tomando una gran importancia. Aquí es donde toma importancia el binomio naturaleza-cuidados (del inglés nature-nurture), entendiendo cuidados como todos los efectos del ambiente sobre nuestro organismo (nutrición, educación, ejercicio, etc).
En la especie humana la heredabilidad (nature) de la longevidad tiene un componente genético menos importante de lo que en un principio se pensaba y en la actualidad se asume que el ambiente (nurture) juega un papel más importante en este proceso. La heredabilidad de la longevidad se ha establecido en aproximadamente un 25% para los gemelos monozigóticos, y un 11% en los mellizos. Para los familiares en primer grado (excluidos mellizos) un reciente estudio de familias centenarias, mostró que si uno de los padres llega a superar los 100 años de vida sus hijos tienen hasta un 20% más de probabilidades de llegar a ser centenarios que los grupos control (Perl et al., 2002). En la Figura 9 aparecen los valores de la heredabilidad de la longevidad en diversos estudios realizados en gemelos y familias longevas frente a grupos control.
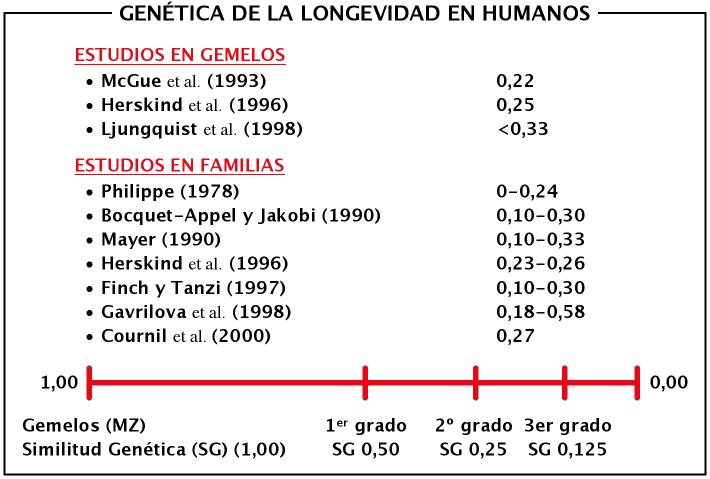
Figura 10. Muestra los resultados de diversos estudios de genética cuantitativa en lo que respecta a la longevidad. La similitud genética de los gemelos monozigóticos es 1, la de los familiares en primer grado (mellizos, padres-hijos o hermanos) es de 0,50, la de los familiares en segundo grado (abuelos-nietos, tíos-sobrinos) es de 0,25 y los familiares en tercer grado (primos) es de 0,125. Las personas no emparentadas tienen un grado de similitud de 0,0. Como se puede ver por los estudios realizados, el ambiente juega un papel cuantitativamente más importante que la heredabilidad en la longevidad (elaboración propia).
Un estudio realizado (Geesaman et al., 2003) comparando hermanos que pertenecían a familias con excepcional longevidad frente a cohortes controles encontró diferencias significativas relacionadas con la longevidad, asociadas a un locus del cromosoma 4. En este locus se identificó un marcador en el gen que codifica la proteína de transferencia microsomal (PTM) como un posible modificador de la longevidad humana. La PTM participa en la síntesis de los diversos tipos de lipoproteínas (HDL y LDL). Su actividad en centenarios se ha relacionado con el menor riesgo de enfermedad cardiovascular, que es una de las principales características de las personas con elevada longevidad. En relación con el metabolismo de los lípidos y el envejecimiento, diversos estudios comparando personas centenarias con controles han mostrado que la disminución de la frecuencia de las variantes de ApoE con el alelo epsilon-4 en los centenarios pudiera estar en la base fisiopatológica del menor riesgo de padecer Alzheimer y enfermedades cardiovasculares por estas personas. Otros estudios sugieren una relación entre los niveles en plasma de insulina, IGF-1 y la longevidad (Holzenberger, et al., 2004).
Como hemos visto, la capacidad del ADN para repararse es un factor importante en la determinación de la longevidad en las especies. Las especies con mecanismos de reparación muy eficaces poseen mayores longevidades. Esto se ha estudiado en la enzima poli (ADP-ribosa) polimerasa-1 (PARP-1), que es un intermediario en la respuesta celular al daño del ADN celular inducido por estrés. En estudios comparativos entre especies, se ha observado que la actividad de la PARP-1 está asociada con la longevidad (Grube y Bürkle, 1992). En este sentido se ha publicado un estudio (Muiras et al., 1998) en el cual se muestra que las personas centenarias tienen niveles más altos de PARP-1 que la población general. Esto sugiere la existencia de una cierta capacidad innata que se asienta en las bases genéticas de la heredabilidad de la longevidad.
6.7.2 Síndromes progeroides (SP)
Las enfermedades que se manifiestan con fenotipos de envejecimiento a edades tempranas constituyen alteraciones genéticas denominadas Síndromes Progeroides (SP) dado que aceleran algunos, aunque no todos, los signos del envejecimiento normal (Tabla 3). La mayoría de los SP están causados por una mutación en un gen que está implicado en uno o más procesos de mantenimiento del genoma lo que ha incrementado aún más la importancia de los sistemas de regulación de las actividades del ADN (replicación, reparación, transcripción y recombinación) durante el envejecimiento. Estas observaciones, una vez más, confirman que la preservación de la integridad del genoma es importante para asegurar la longevidad (Longo y Finch 2003). Es por esto por lo que son considerados modelos humanos para el estudio del envejecimiento, de modo que se piensa que profundizando en el conocimiento de las bases genéticas y moleculares que subyacen en ellos llegaremos a una mejor comprensión de los mecanismos responsables del envejecimiento.
Los SP se clasifican, según el rango de órganos y tejidos en que se manifiesten en SP segmentales (SPS) y unimodales (SPU). Los SPS son aquellos que se expresan en múltiples órganos y tejidos. Por el contrario, los SPU se manifiestan principalmente en un único órgano o tejido. En este apartado nos centraremos en los SPS por ser los modelos más utilizados para el estudio del envejecimiento acelerado en su conjunto (Tabla 3).
|
Síndrome |
Incidencia |
Heredabilidad |
Edad |
E.V. |
Gen(es) |
Posible Defecto |
|
Hutchinson-Gilford |
<1/4.000.000 |
Autosómica dominante |
2 |
13 |
LMNA |
Alteración en la estabilidad nuclear. |
|
Werner |
<1/100.000 |
Autosómica recesiva |
25 |
50 |
WRN |
Reparación de la doble hélice (helicasa). |
|
Cockayne |
1/100.000 |
Autosómica recesiva |
5 |
20 |
CSA CSB XPD XPG |
Reparación relacionada con la trascripción y escisión de nucleótidos. |
|
Ataxia-telangectasia |
1/60.000 |
Autosómica recesiva |
10 |
20 |
ATM |
Respuesta al daño del ADN. |
|
Down |
1/1.000 |
De novo |
40 |
60 |
Trisomía 21 |
Antioxidante, APP. |
Tabla 3. Se muestran algunos de los síndromes humanos que cursan con envejecimiento acelerado (síndromes progeroides segmentarios). En la columna “edad” se indica la de inicio de los signos clínicos de envejecimiento y en la columna E.V la esperanza de vida. Ambos valores se indican en años. Mientras que para el resto de síndromes los valores parecer ser muy estables, en el caso del síndrome de Down los valores de longevidad se están incrementando de forma notable en las últimas décadas (adaptado de Vijg y Suh, 2005).
6.7.2.1 El Síndrome de Hutchinson-Gilford (SHG)
El SHG también denominado “progeria” o “progeria infantil” fue descrito por Hutchinson en 1886 y posteriormente Gilford en 1904 utilizó para designarlo el término progeria (del griego, gêras, vejez). Desde entonces sólo se han descrito un centenar de casos en la literatura médica.
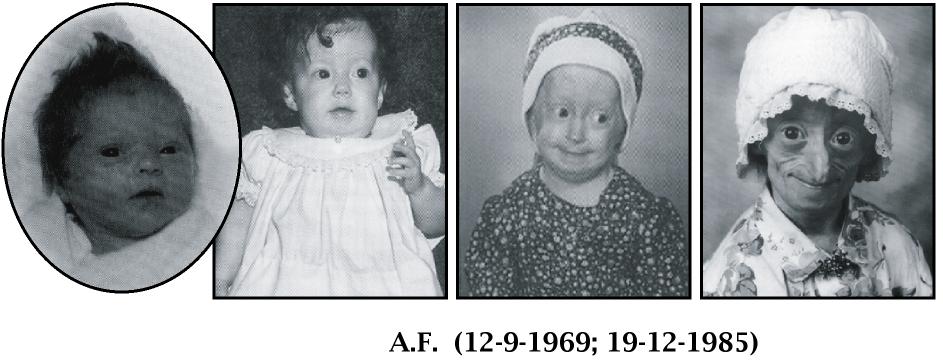
Figura 11. Síndrome de Hutchinson-Gilford (SHG). Imagen realizada con fotografías amablemente cedidas por The Progeria Research Foundation (EE.UU.).
La Progeria afecta a 1 de cada 4-8 millones de recién nacidos. Los niños afectados no presentan ninguna manifestación fenotípica al nacer pero estas aparecen de forma temprana (6-12 meses), y la clínica ya es manifiesta a los 2 años. Se caracterizan por retraso en el desarrollo (baja talla e hipoplasia facial), alteraciones en piel (visualización de la vasculatura subcutánea) y anejos (alopecia), y en la distribución de la grasa corporal (delgado panículo adiposo), siendo los desarrollos psicomotriz y mental normales. El sistema cardiovascular está afectado de forma temprana por aterosclerosis grave y generalizada. La supervivencia media es de 13 años y la muerte es generalmente consecuencia de complicaciones cardiovasculares.
El SHG se trasmite de forma autosómica dominante y se debe en la mayor parte de los casos a una mutación puntual de novo y transmitida vía paterna en el gen LMNA (locus 1q21.2) que codifica las laminas A y C. Este gen está formado por 12 exones y comprende aproximadamente 25kb (la lamina A está codificada por los exones 1-12 y la C por los exones 1-10). La mayoría de los casos estudiados tienen la misma mutación de novo en el exón 11 (G608G –GGC>GGT) que se cree activa un sitio de corte y empalme, lo cual provoca que a la lamina A resultante le falten 50 aminoácidos en el extremo carboxi-terminal (lamina A, δ50) que resulta en una pérdida de un sitio para su fosforilación lo cual altera la regulación del ciclo celular.
Entre las características de las células en el SHG se han encontrado alteraciones en la membrana nuclear de los fibroblastos. Estas alteraciones incluyen lobulación de la membrana nuclear, pérdida de la heterocromatina periférica, engrosamiento de la lámina nuclear y agrupamiento de los poros nucleares. Estas alteraciones se agravan en fibroblastos in vitro a medida que envejecen. Además se observa una rápida proliferación inicial seguida de un incremento de la apoptosis y la senescencia celular que correlaciona con el acortamiento de los telómeros, pues estos fibroblastos sólo se dividen unas 27 veces (Pollex y Hegele, 2004).
Se ha demostrado también que existe una alteración de la expresión génica en fibroblastos de pacientes con progeria. Entre los genes mal regulados se encuentran aquellos que codifican factores de transcripción y proteínas de la matriz extracelular, muchos de los cuales están implicados en la aparición y evolución de la aterosclerosis.
Recientemente (Scaffidi y Mistela, 2005) se ha conseguido revertir el fenotipo celular en fibroblastos de personas afectadas por SHG. Para esto fue necesario eliminar el alelo mutado mediante un oligonucleótido modificado ya que la mutación tiene un efecto dominante negativo. Después de esta corrección, en los fibroblastos SHG se normalizan: la morfología nuclear, los niveles de proteínas asociadas a la lamina y la expresión de aquellos genes que están mal regulados.
6.7.2.2 Síndrome de Werner (SW)
El SW o progeria del adulto es el síndrome progeroide más frecuente, ya que se calcula que en el mundo lo padecen actualmente unas 1300 personas. Este síndrome se transmite de forma autosómica recesiva y se produce por mutaciones en el gen WRN, locus 8p12-p11.2, que codifica la helicasa WRN (WRNp) perteneciente a la familia de helicasas RecQ. La proteína WRN es una enzima bifuncional que posee un dominio con actividad 3’-5’helicasa ATP dependiente y ATPasa ADN dependiente (común a la familia de helicasas RecQ) y otro dominio 3’-5’ exonucleasa similar al dominio exonucleasa de la ADN polimerasa I del E. coli. La WRNp interacciona con una gran variedad de proteínas (ARN polimerasa I, ADN polimerasa δ, y p53 entre otras), lo que sugiere que puede tener un papel tanto en la replicación del ADN como en la recombinación. La alteración de estas funciones parece ser la base de la inestabilidad genómica de las células de estos pacientes, pues, presentan frecuentes aneuploidias, reordenamientos, translocaciones e inversiones, así como una alta proporción de deleciones y mutaciones en diversos loci.
Los fibroblastos de las personas con SW tienen una capacidad proliferativa muy limitada (unas 20 duplicaciones). Este hecho se ha relacionado con alteraciones en la dinámica de los telómeros, pues se ha observado que estos en las células SW se acortan en igual longitud que los controles en primeras divisiones, pero lo hacen en mayor longitud en las últimas divisiones. Sin embargo, los telómeros de células senescentes SW son más largos que los de células senescentes no SW y la expresión forzada de la telomerasa hTERT disminuye el ritmo de senescencia en fibroblasto SW aparentemente en la misma forma que en los fibroblastos normales. Este acortamiento telomérico se ha sugerido que determinaría el relativamente tardío inicio de los síntomas del SW, pues haría falta un número de divisiones celulares para alcanzar la distancia crítica (mínima) de los telómeros (Schulz et al., 1996).
Las personas afectadas de SW se desarrollan normalmente hasta la pubertad, siendo entonces cuando se aprecia la primera manifestación, que es la ausencia de la típica aceleración del crecimiento que provoca que tengan baja talla. En la tercera década de vida aparece canicie, calvicie, atrofia cutánea y ronquera y posteriormente, cataratas, diabetes mellitus tipo 2, hipogonadismo, arteriosclerosis, úlceras cutáneas y osteoporosis. Los cambios morfológicos en la cara incluyen el afilamiento de la nariz (cara de pájaro). La esperanza de vida es de 47 años, siendo las causas más frecuentes de muerte el cáncer y el infarto de miocardio.
Algunos pacientes incluidos en el SW no tienen alteraciones en la proteína WRN y en ellos se observa un comienzo más precoz de la clínica (alrededor de los 13 años) que en el SW y se denomina SW atípico (SWA). En el 15% de estas personas con SWA en heterozigosis aparece una mutación de novo en el gen LMNA, por lo que esta patología se puede clasificar dentro del grupo de las laminopatías. Este hallazgo ha abierto el debate sobre dónde establecer el límite clínico entre SW grave y SHG leve (Kipling et al. 2004).
6.7.2.3 Síndrome de Cockayne (SC)
El SC agrupa un conjunto heterogéneo de enfermedades en el que se incluyen el SC tipo A o tipo I (SCA); el tipo B o tipo II (SCB); el tipo III (muy poco frecuente) y el Xeroderma pigmentosum-Cockayne (XP-CS). Desde el punto de vista clínico existe una gran variedad de manifestaciones clínicas de este síndrome. Las principales son apariencia senil, retraso del crecimiento, hipogonadismo, alteraciones neurológicas progresivas y desmielinización difusa. En el SC no hay un mayor riesgo de padecer cáncer, pero en el XP-CS el riesgo es 1000 veces mayor que en la población normal (ver capítulo de reparación del ADN). Las causas más frecuentes de muerte son alteraciones neurológicas o infecciones respiratorias.
El SCA está provocado por mutaciones en los genes CKN1 (locus 5p12.3) el SCB por genes ERCC6 (locus 10p11) y algunas mutaciones en genes del Xeroderma pigmentosum (XPD y XPG). Estas bases moleculares sugieren que las diversas variedades de SC se deben a alteraciones en la transcripción y en la reparación del ADN, concretamente en este síndrome se afecta la vía de escisión de nucleótidos.
Estos síndromes progeroides (el síndrome de Down es tratado específicamente en el capítulo 15) nos confirman la gran importancia que tienen los procesos de mantenimiento de la integridad del genoma y su reparación en su relación con la longevidad.
6.8 El futuro en el presente: la animación suspendida y la criogenización
Diversos organismos son, por su naturaleza, capaces de entrar en un proceso de letargo fisiológico denominado animación suspendida (letargo, diapausa, etc.) durante periodos variables de tiempo. Este estado de animación suspendida (AS) se considera una forma extrema de quiescencia celular y del organismo en la cual cesa la actividad vital a un estado de quasi-muerte fisiológica. Se ha vista que la AS conlleva una drástica reducción en el consumo de oxígeno y además, aunque parezca paradójico, los animales en este estado se recuperan mejor de lesiones experimentales que aquellos que no estaban en AS (Nystul y Roth, 2004).
Los animales aerobios dependemos del oxígeno que llega a las células (mitocondrias) transportado por la hemoglobina de los eritrocitos para obtener ATP (fosforilación oxidativa). Dado que las reservas de ATP en las células son muy bajas, su síntesis debe ser continua, de tal manera que cualquier disminución en la oxigenación celular compromete la vida celular por agotamiento inmediato de las reservas de ATP. Además la hipoxia induce una mayor producción de RLO con lo cual la apoptosis celular se induce inmediatamente. Paradójicamente, en los animales en AS o estados funcionales similares se reduce drásticamente la actividad celular, lo que les hace muy resistentes a la isquemia celular durante el periodo de falta de oxígeno.
Como ya sabemos, C. elegans entra en diapausa cuando las condiciones del medio no le son favorables. Otros organismos más evolucionados también pueden entrar de forma natural en un periodo de letargo por hibernación (ardillas del ártico, osos, etc.) o estivación (ranas del desierto, salamandras, etc.). Los embriones de C. elegans pueden iniciar la AS si el oxígeno desciende al 0,001% (anoxia), permanecer así 24 horas, y posteriormente recuperar su funcionalidad cuando se alcanzan las concentraciones atmosféricas (21%). Por el contrario, si la concentración de O2 está entre 0,01 y 0,1% (hipoxia) los embriones del gusano no inician la AS, sino que continúa el proceso de embriogénesis y mueren en unas 24 horas. En concentraciones de O2 ya próximas al 5% (hipoxia) el gusano efectúa sus fases de desarrollo con normalidad. ¿Qué hace que ciertas concentraciones de O2 induzcan AS, diferenciación o muerte?. En este sentido se ha identificado el gen san-1 que es necesario para que los embriones de C. elegans entren en AS. En AS inducida por anoxia, los embriones que no expresan SAN-1 (una proteína fundamental para la unión de los cromosomas al cinetocoro) u otra proteína semejante que también actúa como control del huso mitótico (MDF-2), no pueden parar el ciclo celular, presentan una alteración en la segregación de los cromosomas y se altera la viabilidad celular. Estos datos sugieren un papel sobre la dinámica de los procesos biológicos que subyacen a la AS (Nystul et al., 2003).
Estas observaciones experimentales han abierto un nuevo campo de trabajo que consiste en la preservación de células, tejidos, órganos y ¿organismos superiores? y, por paradójico que pueda sonar, en anoxia. Estudios experimentales en C. elegans sustituyendo O2 por CO (monóxido de carbono) que compite con el O2 por unirse al citocromo c oxidasa en las mitocondrias pero no forma ATP han mostrado que los embriones entran en AS y evitan de esta forma los efectos de la isquemia celular.
Los animales que hibernan (heterotermos) están protegidos en este estado de AS de las lesiones inducidas experimentalmente (Drew et al., 2004). Estas observaciones han animado a realizar estudios de inducción de AS en animales que no hibernan (perros y cerdos) sustituyendo la sangre por suero salino lo que crea una anoxia tisular. En perros se ha conseguido la AS durante una hora, pero un pequeño grupo presentó ligeras alteraciones neurológicas tras la recuperación, mientras que en cerdos (Alman et al., 2005) se ha señalado la ausencia total de alteraciones neurológicas tras la AS.
Estas aproximaciones abren un nuevo campo de investigación que en un principio pudiera tener importancia para el mantenimiento de células aisladas, tejidos u órganos destinados a transplantes y finalmente, para retardar el envejecimiento ¿el mantenimiento de personas en AS?. En este sentido una nueva línea de investigación se abrió al utilizar como inductor de la AS en ratones el sulfuro de hidrógeno (H2S) al 0,008%. En estas circunstancias los ratones disminuyeron sus funciones vitales (temperatura, pulso, etc.) y se mantuvieron en AS durante seis horas. Tras este periodo los animales se recuperaron y no mostraron ningún tipo de alteración funcional.
También se conoce en la literatura diversos casos en los cuales personas que han caído en lagos helados han entrado en hipotermia y algunas se han recuperado de esta situación sin alteraciones físicas (Walpoth et al., 1997). Las bajas temperaturas conseguidas mediante nitrógeno líquido están en el fundamento de la preservación de células (zigotos, etc.). Esto ha llevado a la iniciación de la criogenización con el objetivo de mantener organismos después de muertos para ser re-vitalizados pasado el tiempo. La criogenización implica la muerte del organismo y eso ya se escapa del objetivo de este libro.
Referencias
- Alam H. B., Chen Z., Ahuja N., Chen H., Conran R., Ayuste E. C., Toruno K., Ariaban N., Rhee P., Nadel A., Koustova E. Profound hypothermia protects neurons and astrocytes, and preserves cognitive functions in a Swine model of lethal hemorrhage. J. Surg. Res. 2005;126:172-181.
- Amdam G. V., Norberg K., Fondrk M. K., Page R. E. Jr. Reproductive ground plan may mediate colony-level selection effects on individual foraging behavior in honey bees. Proc. Natl. Acad. Sci. U S A. 2004;101:11350-11355.
- Arking R., Buck S., Novoseltev V. N., Hwangbo D. S., Lane M. Genomic plasticity, energy allocations, and the extended longevity phenotypes of Drosophila. Ageing Res. Rev. 2002;1:209-228.
- Bachrati C. Z., Hickson I. D. RecQ helicases: suppressors of tumorigenesis and premature aging. Biochem. J. 2003;374:577-606.
- Barja G. Rate of generation of oxidative stress-related damage and animal longevity. Free Radic. Biol. Med. 2002;33:1167-1172.
- Brown-Borg H. M., Borg K. E., Meliska C. J., Bartke A. Dwarf mice and the ageing process. Nature. 1996;384:33.
- Chen C., Contreras R. The bud scar-based screening system for hunting human genes extending life span. Ann. N. Y. Acad. Sci. 2004;1019:355-359.
- Cohen H. Y., Miller C., Bitterman K. J., Wall N. R., Hekking B., Kessler B., Howitz K. T., Gorospe M., de Cabo R., Sinclair D. A. Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase. Science. 2004;305:390-392.
- Coschigano K. T., Holland A. N., Riders M. E., List E. O., Flyvbjerg A., Kopchick J. J. Deletion, but not antagonism, of the mouse growth hormone receptor results in severely decreased body weights, insulin, and insulin-like growth factor I levels and increased life span. Endocrinology. 2003;144:3799-3810.
- Drew K. L., Harris M. B., LaManna J. C., Smith M. A., Zhu X. W., Ma Y. L. Hypoxia tolerance in mammalian heterotherms. J. Exp. Biol. 2004;207:3155-3162.
- Fabrizio P., Pletcher S. D., Minois N., Vaupel J. W., Longo V. D. Chronological aging-independent replicative life span regulation by Msn2/Msn4 and Sod2 in Saccharomyces cerevisiae. FEBS Lett. 2004;557(1-3):136-142.
- Friedman D. B., Johnson T. E. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility. Genetics. 1988;118:75-86.
- Geesaman B. J., Benson E., Brewster S. J., Kunkel L. M., Blanche H., Thomas G., Perls T. T., Daly M. J., Puca A. A. Haplotype-based identification of a microsomal transfer protein marker associated with the human lifespan. Proc. Natl. Acad. Sci. USA. 2003;100:14115-14120.
- Godfrey P., Rahal J. O., Beamer W. G., Copeland N. G., Jenkins N. A., Mayo K. E. GHRH receptor of little mice contains a missense mutation in the extracellular domain that disrupts receptor function. Nat. Genet. 1993;4:227-232.
- Guarente L., Picard F. Calorie restriction the SIR2 connection. Cell. 2005;120:473-482.
- Holzenberger M., Kappeler L., De Magalhaes Filho C. IGF-1 signaling and aging. Exp. Gerontol. 2004;39:1761-1764.
- Imai S., Armstrong C. M., Kaeberlein M., Guarente L. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase. Nature. 2000; 403:795-800.
- Kaeberlein M., Kennedy B. K. Large-scale identification in yeast of conserved ageing genes. Mech. Ageing Dev. 2005;126:17-21.
- Kenyon C., Chang J., Gensch E., Rudner A., Tabtiang R. A C. elegans mutant that lives twice as long as wild type. Nature. 1993;366:461-464.
- Klass M., Hirsh D. Non-ageing developmental variant of Caenorhabditis elegans. Nature. 1976;260:523-525.
- Kipling D., Davis T., Ostler E. L., Faragher R. G. What can progeroid syndromes tell us about human aging? Science. 2004;305:1426-1431.
- Laron Z. Do deficiencies in growth hormone and insulin-like growth factor-1 (IGF-1) shorten or prolong longevity? Mech. Ageing Dev. 2005;126:305-307.
- Liang H, Masoro E. J., Nelson J. F., Strong R., McMahan C. A., Richardson A. Genetic mouse models of extended lifespan. Exp. Gerontol. 2003;38:1353-1364.
- Lin Y. J., Seroude L., Benzer S. Extended life-span and stress resistance in the Drosophila mutant methuselah. Science. 1998;282:943-946.
- Longo V. D., Ellerby L. M., Bredesen D. E., Valentine J. S., Gralla E. B. Human Bcl-2 reverses survival defects in yeast lacking superoxide dismutase and delays death of wild-type yeast. J. Cell. Biol. 1997;137:1581-1588.
- Longo V. D., Finch C. E. Evolutionary medicine: from dwarf model systems to healthy centenarians?. Science. 2003;299:1342-1346.
- Lutz P. L., Prentice H. M., Milton S. L. Is turtle longevity linked to enhanced mechanisms for surviving brain anoxia and reoxygenation? Exp. Gerontol. 2003;38:797-800.
- Maier B., Gluba W., Bernier B., Turner T., Mohammad K., Guise T., Sutherland A., Thorner M., Scrable H. Modulation of mammalian life span by the short isoform of p53. Genes Dev. 2004;18:306-319.
- Minois N. Longevity and aging: beneficial effects of exposure to mild stress. Biogerontology. 2000;1:15-29.
- Minois N., Frajnt M., Wilson C., Vaupel J. W. Advances in measuring lifespan in the yeast Saccharomyces cerevisiae. Proc. Natl. Acad. Sci. USA. 2005;102:402-406.
- Migliaccio E., Giorgio M., Mele S., Pelicci G., Reboldi P., Pandolfi P. P., Lanfrancone L., Pelicci P. G. The p66shc adaptor protein controls oxidative stress response and life span in mammals. Nature. 1999;402:309-313.
- Nystul T. G., Goldmark J. P., Padilla P. A., Roth M. B. Suspended animation in C. elegans requires the spindle checkpoint. Science. 2003;302:1038-1041.
- Nystul T. G., Roth M. B. Carbon monoxide-induced suspended animation protects against hypoxic damage in Caenorhabditis elegans. Proc. Natl. Acad. Sci. USA. 2004;101: 9133-9136.
- Pandolfi S., Bonafe M., Tella L. D., Tiberi L., Salvioli S., Monti D., Sorbi S., Franceschi C. p66(shc) is highly expressed in fibroblasts from centenarians. Mech. Ageing Dev. 2005;126:839-844.
- Perls T. T., Wilmoth J., Levenson R., Drinkwater M., Cohen M., Bogan H., Joyce E., Brewster S., Kunkel L., Puca A. Life-long sustained mortality advantage of siblings of centenarians. Proc. Natl. Acad. Sci. USA. 2002;99:8442-8447.
- Pollex R. L., Hegele R. A. Hutchinson-Gilford progeria syndrome. Clin. Genet. 2004; 66:375-381.
- Rodriguez-Aguilera J. C., Gavilan A., Asencio C., Navas P. The role of ubiquinone in Caenorhabditis elegans longevity. Ageing Res. Rev. 2005;4:41-53.
- Ruppell O., Pankiw T., Page R. E. Jr. Pleiotropy, epistasis and new QTL: the genetic architecture of honey bee foraging behavior. J. Hered. 2004;95:481-491.
- Scaffidi P., Misteli T. Reversal of the cellular phenotype in the premature aging disease Hutchinson-Gilford progeria syndrome. Nat. Med. 2005;4:440-445.
- Snell G. D. Dwarf, a new Mendelian recessive carácter of the house mouse. Proc. Natl. Acad. Sci. USA. 1929;15:733-734.
- Schultz V. P., Zakian V. A., Ogburn C. E., McKay J., Jarzebowitz A. A., Edland S. D., y Martin G. M. Accelerated loss of telomeric repeats may not explain accelerated replicative decline of Werner syndrome cells. Hum. Genet. 1996;97:750–754.
- Takeda T. Senescence-accelerated mouse (SAM): a biogerontological resource in aging research. Neurobiol. Aging. 1999;20:105-110.
- Temple M. D., Perrone G. G., Dawes I. W. Complex cellular responses to reactive oxygen species. Trends Cell Biol. 2005;15:319-326.
- Tissenbaum H. A., Guarente L. Increased dosage of a sir-2 gene extends lifespan in Caenorhabditis elegans. Nature. 2001;410:227-230.
- Trinei M., Giorgio M., Cicalese A., Barozzi S., Ventura A., Migliaccio E., Milia E., Padura I. M., Raker V. A., Maccarana M., Petronilli V., Minucci S., Bernardi P., Lanfrancone L., Pelicci P. G. A p53-p66Shc signalling pathway controls intracellular redox status, levels of oxidation-damaged DNA and oxidative stress-induced apoptosis. Oncogene. 2002;21:3872-3878.
- Vijg J., Suh Y. Genetics of longevity and aging. Annu Rev. Med. 2005;56:193-212.
- Walpoth B. H., Walpoth-Aslan B. N., Mattle H. P., Radanov B. P., Schroth G., Schaeffler L., Fischer A. P., von Segesser L., Althaus U. Outcome of survivors of accidental deep hypothermia and circulatory arrest treated with extracorporeal blood warming. N. Engl. J. Med. 1997;337:1500-1505.