• MC-F-007. Capítulo 7. Daño oxidativo y envejecimiento.
7.1 El envejecimiento como fenómeno biológico
El envejecimiento se define como un fenómeno biológico complejo, caracterizado por una pérdida progresiva de la capacidad del individuo para mantener sus funciones vitales, incrementándose de esta forma el riesgo de muerte; podemos considerarlo además como universal, degenerativo e irreversible. En la actualidad se asume que el envejecimiento existe porque no actúa sobre él la selección natural, y debido además a los costes metabólicos inherentes al mantenimiento de las actividades vitales. No existe todavía un consenso sobre los mecanismos bioquímicos y/o genéticos específicos que desencadenan y mantienen el proceso.
Como corresponde a un fenómeno complejo, cuyo estudio se aborda desde varias disciplinas, se han propuesto una serie de teorías que tratan de explicar de qué forma se produce. Entre ellas hay una que sugiere que este se debe –en último término– a una acumulación de daños moleculares aleatorios en células y tejidos (Johnson et al., 1999). Esta hipótesis plantea además que, en los seres vivos, la velocidad de envejecimiento vendría determinada por la acción de dos fenómenos contrapuestos: uno de deterioro en los componentes celulares, y otro en el que intervendrían sistemas para compensar o reparar dicho deterioro. Como en todo lo que afecta a los seres vivos, existe en este sistema una interacción compleja y constante entre genoma y ambiente, y en muchos casos es difícil especificar la influencia de cada uno de ellos. El ritmo de envejecimiento varía considerablemente entre especies e individuos de una misma especie además, dentro de un mismo individuo, diferentes órganos y tipos celulares de un mismo tejido pueden envejecer a diferente ritmo en una secuencia de acontecimientos aparentemente aleatoria. No se ha podido esclarecer por el momento si existe –a nivel de especie– una programación genética del mismo, como ocurre con el desarrollo embrionario y otros fenómenos biológicos programados.
7.2 Teoría del envejecimiento por daño oxidativo
Harman fue quien en 1956 la propuso por vez primera, y postula que: “el envejecimiento es una consecuencia de la acumulación de cambios moleculares que tienen lugar en el organismo, y que estarían causados por radicales libres”, en este sentido los cambios originados por dichos radicales serían una causa importante de envejecimiento, al deteriorar estructural y funcionalmente las diferentes biomoléculas. Estos radicales libres procederían de una fuente endógena (subproductos del metabolismo celular) o exógena (fármacos, humos, radiaciones, etc.).
La organización compleja de los organismos vivos requiere de energía para poder mantener sus actividades vitales, esta energía la obtienen muchos organismos de la respiración aerobia, debido a que es la forma de metabolización que produce mayor rendimiento energético. No obstante, y por esta razón, los seres vivos que consumen oxígeno en su metabolismo están expuestos de forma permanente a la presencia de subproductos tóxicos (radicales libres, peróxido de hidrógeno, etc.) de dicho elemento conocidas genéricamente como “especies reactivas del Oxígeno”, que en este trabajo las denominaremos RLO (Radicales Libres del Oxígeno) y RLN (Radicales Libres del Nitrógeno). Hay que hacer constar el hecho de que bajo la denominación de RLO y RLN se incluyen no solo radicales libres, sino también otros derivados no radicales pero que tienen alta reactividad como agentes de oxido-reducción, tales como el peróxido de hidrógeno (H2O2) o el peroxinitrito (OONO-).
La aparición de oxígeno molecular en la atmósfera de la tierra tuvo lugar hace aproximadamente 2.000 millones de años (Riere Codina, 2002) lo que permitió el desarrollo posterior de seres vivos con metabolismo aerobio. Teniendo en cuenta la estricta dependencia de la respiración de oxígeno en la mayor parte de los seres pluricelulares, y la toxicidad de muchos de los subproductos del metabolismo aerobio, resulta lógico pensar que, a lo largo del proceso evolutivo, dichos organismos han tenido que desarrollar toda una serie de mecanismos que los protegen de los derivados tóxicos del oxígeno. De esta forma podemos imaginar un panorama celular en el que estarían presentes, a bajas concentraciones, metabolitos tóxicos que serían neutralizados con mayor o menor especificidad y eficiencia, cuando la acción de tales mecanismos neutralizantes resulta insuficiente nos encontramos en una situación conocida como “estrés oxidativo”, en este caso los oxidantes no neutralizados reaccionarían con biomoléculas tales como proteínas, lípidos, ácidos nucleicos, etc., dañándolas. La acumulación de lesiones moleculares traería como consecuencia el deterioro de funciones celulares y tisulares con manifestaciones fenotípicas en forma de procesos degenerativos, disfunciones asociadas a envejecimiento, que provocarían una alteración irreversible de la homeostasis hasta un límite incompatible con la vida (Finkel y Holbrook, 2000) (Figura 1).
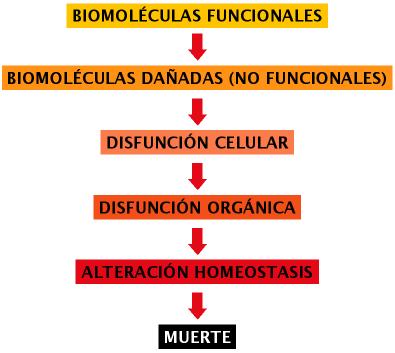
Figura 1. Evolución del proceso degenerativo en el envejecimiento. En el esquema se representa el deterioro de la homeostasis celular originado por la alteración a nivel molecular.
Sería pues la interacción entre sistemas productores de derivados tóxicos del oxígeno, y mecanismos neutralizantes de los mismos, lo que determinaría la velocidad a la que se produce el “deterioro” molecular y, con ello, el envejecimiento (Figura 2).
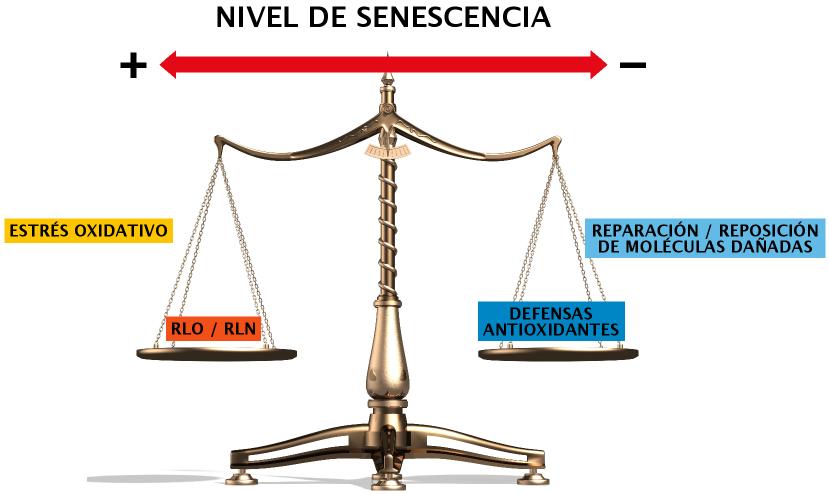
Figura 2. Balanza del envejecimiento. Daño oxidativo. Según la teoría del daño oxidativo el envejecimiento progresaría en la medida en que la cantidad agentes tóxicos presentes en el entorno celular superarse la capacidad de la célula para neutralizarlos o contrarrestar sus efectos.
Cuando en este contexto nos referimos a la “toxicidad” del O2, asumimos que este gas en sí no presenta apenas toxicidad en medios biológicos, debido a que su reactividad química no es elevada frente a la mayor parte de las biomoléculas. La toxicidad asociada al oxígeno se debe fundamentalmente a los productos citados anteriormente (RLO) que se pueden considerar como formas activadas del mismo, de entre todas ellas la más dañina es la conocida como radical hidroxilo (OH. ). El origen más frecuente de este radical en los seres vivos es el proceso químico conocido como la reacción de Fenton, que se comentará más adelante, y en la que intervendrían el peróxido de hidrógeno y Fe++ ó Cu++. La importancia de dicho radical se comprende si pensamos que tanto el oxígeno como el hierro comparten con frecuencia espacios celulares.
Hoy en día son numerosos los argumentos a favor de esta teoría, entre ellos:
- A) Se ha podido comprobar como el aumento de la expresión de genes que codifican para enzimas que neutralizan RLO prolongan la vida media en invertebrados.
- B) La longevidad de diferentes especies de mamíferos guarda una relación inversa con la tasa metabólica y por consiguiente con la producción de RLO en sus mitocondrias.
- C) La evidencia de que la restricción calórica retrasa el envejecimiento pudiera estar relacionada con la hipótesis del papel de RLO en el envejecimiento, ya que los animales sometidos a tal práctica tienen un menor nivel de RLO en sus células y tejidos (Sohal, 1996).
No obstante hay que ser cautos a la hora de interpretar estos resultados y sobre todo cuando los mismos tratan de extrapolarse al ser humano.
7.3 ¿Qué son los radicales libres?
Los radicales libres son especies químicas capaces de existir independientemente, y que tienen electrones desapareados en sus orbitales externos (el punto que aparece en las fórmulas químicas de los radicales hace referencia al electrón desapareado). Esta circunstancia los hace altamente reactivos, ya que tienden a compensar el desequilibrio electrónico cediendo o capturando electrones de otras moléculas del entorno, por lo que actuarían de agentes reductores en el primer caso y oxidantes en el segundo (este más frecuente en el entorno celular). Existen muchos tipos de radicales libres en la naturaleza, debido a su alta reactividad suelen tener una vida media corta, y por ello son difíciles de detectar, por regla general su presencia se infiere por los cambios característicos que producen en otras moléculas de su entorno próximo.
7.3.1 Radicales libres derivados del oxígeno (RLO)
Como se comentó en el apartado anterior, el término “radicales libres del oxígeno” o especies reactivas del oxígeno (RLO) engloba no solamente a los verdaderos radicales derivados del oxígeno, como el superóxido (O2. - ) o el hidroxilo (OH.) (no confundir con el ión hidroxilo OH- que no es un radical libre), sino que en él se incluyen además moléculas no radicales como: H2O2, ozono (O3), etc. Bajo el punto de vista químico tanto el O2. - como el H2O2 no son muy reactivos frente a la mayoría de las biomoléculas en soluciones acuosas y en condiciones fisiológicas (aunque lo son bastante más que el O2) si las comparamos con la actividad del radical OH., el problema que plantean aquellos es que, en determinadas circunstancias del entorno celular, se transforman en radicales hidroxilo. Otro aspecto a tener en cuenta es la capacidad del H2O2 para difundir a través de la bicapa lipídica, lo que hace posible su presencia por difusión en diferentes compartimentos celulares. Esta circunstancia aumenta las probabilidades de que el H2O2 pueda reaccionar con átomos de Fe++ celular produciendo radicales hidroxilo.
7.4.2 ¿En qué lugares del organismo se producen los RLO/RLN?
7.4.2.1 Procesos metabólicos diversos
- Sistema del Citocromo P-450. La fracción microsomal de algunos tejidos producen in vitro radical superóxido cuando se los incuba en presencia de NADPH, en este caso los radicales son producidos mayoritariamente por el sistema denominado genéricamente como sistema del citocromo P450. Este complejo enzimático está compuesto por una familia de citocromos (proteínas con grupo hemo) involucrados en la hidroxilación de numerosos sustratos en presencia de O2 (actuando el NADPH como dador de electrones). En estos procesos un átomo de O se reduce para dar H2O a expensas de los electrones obtenidos del sustrato, actuando los citocromos como catalizadores del proceso. El sistema de citocromos P450 se localiza en el retículo endoplásmico y otros orgánulos celulares de plantas y animales (sobre todo en el hígado de los animales). Este sistema es el encargado de metabolizar, entre otros, compuestos extraños al organismo (xenobióticos) como contaminantes de origen diverso, medicamentos, etc. Lo que hace en realidad el sistema es tratar de hacer estos compuestos más hidrosolubles y menos tóxicos, favoreciendo con ello su neutralización y eliminación, aunque en algunas ocasiones se genera un subproducto que es más tóxico que el sustrato de la reacción (tal es el caso del H2O2 o el O2.-).
- Degradación de purinas. Otro proceso metabólico que produce RLO es el de la oxidación de la xantina por la xantina oxidasa, este enzima participa en la vía degradativa de las purinas y cataliza el paso de xantina a ácido úrico (Figura 3):
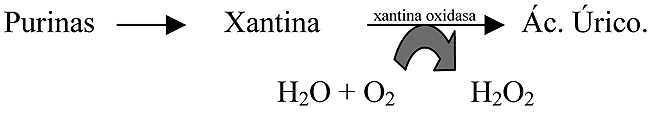
Figura 3. Producción de H2O2 en la degradación de purinas.
7.4.2.2 Procesos de autooxidación
Algunas biomoléculas pueden oxidarse en presencia del O2 produciéndose como consecuencia radicales superóxido. Algunas de estas moléculas son: FADH2, adrenalina, noradrenalina, L-DOPA, dopamina, etc. Se cree que muchas de estas oxidaciones se desencadenan por la presencia de ciertos metales de transición (Fe, Cu) dado que el O2 por sí solo no es suficientemente reactivo como para iniciar el proceso. Tanto la L-DOPA como la dopamina se oxidan in vitro dando como producto de la reacción radical superóxido y H2O2, parece que el desencadenante de este proceso pudiera ser el Fe++ presente en el entorno. Este tipo de reacciones, al igual que muchas de las que provocan los radicales libres, se caracteriza por ser un proceso en cadena, esto es: una vez que tiene lugar la primera reacción, el proceso se mantiene, actuando uno o varios productos de la misma como oxidantes en la siguiente, un proceso similar ocurre en la peroxidación de ciertos lípidos. Este tipo de reacciones es de gran importancia de cara a su participación en determinados procesos degenerativos, debido a la gran cantidad de biomoléculas susceptibles de sufrir el mismo tipo de modificación.
7.4.2.3 Oxidación de Hemoproteínas de transporte gaseoso
Tanto en la hemoglobina como en la mioglobina el transporte gaseoso no implica, en principio, tránsito electrónico oxidativo entre el O2 y el Fe++, pero en algunas ocasiones un electrón del hierro pasa al oxígeno produciéndose entonces la oxidación del hierro a Fe+++ y la formación de radical superóxido (Figura 4).
![]()
Figura 4. Formación de radical superóxido por oxidación del Fe++ de la hemoglobina.
El compuesto Hem-Fe+++ es la metahemoglobina y es incapaz de fijar O2. Se calcula que aproximadamente un 3% de la hemoglobina humana sufre este proceso cada día, y se acelera en presencia de ciertos metales de transición, nitratos, etc. Además ciertas patologías asociadas a hemoglobinas defectuosas son más susceptibles de formar derivados oxidados, lo que acentúa aún más el problema en individuos que padezcan dichas patologías.
7.4.2.4 Transporte electrónico en la cadena respiratoria mitocondrial
Probablemente sea esta la mayor fuente de producción de RLO en la célula. Esta circunstancia se debe a la fuga de electrones que tiene lugar durante el tránsito de los mismos por los componentes de la cadena de transporte electrónico en la respiración aerobia (Balaban et al., 2005). Dichos electrones “fugados” van a producir una reducción parcial del O2 y, como consecuencia, se generan radicales superóxido (Figura 5).
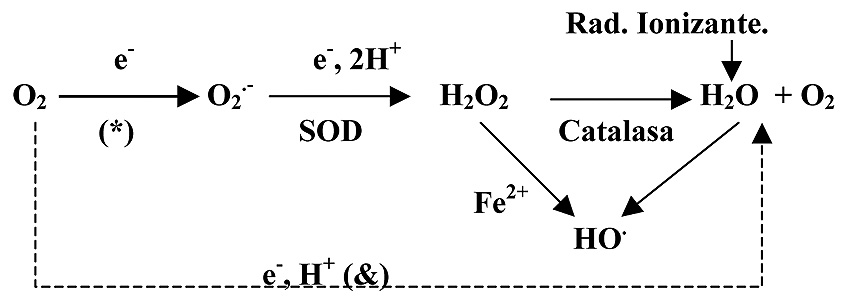
Figura 5. Conversión del O2 en radicales libres y H2O2.
(*) Aunque la eficiencia de la cadena de transporte electrónico es alta en condiciones normales, algunos de los derivados reducidos del oxígeno se escapan de la cadena, tal es el caso del radical superóxido (O2.-).
(&) En la respiración aerobia, la transferencia de los electrones (e-) desde los sustratos hasta el O2, genera la energía que mantiene la producción de ATP.
Se piensa que a tensiones de oxígeno normales, el porcentaje de electrones que se “escapan” de la cadena de transporte es de un 0,2-1% (estas cifras varían en función de las condiciones del ensayo) pudiendo llegar hasta el 18% en atmósferas de 85% de O2 (Halliwell y Gutteridge, 1999). Por ello resulta importante el mantenimiento de los componentes de la cadena de transporte en un funcionamiento óptimo, ya que de lo contrario se podría elevar el porcentaje de moléculas de superóxido formadas en el tránsito electrónico, generándose entonces una situación de “estrés oxidativo”.
Un aspecto importante a tener en cuenta –si consideramos la gran cantidad de radicales que se pueden formar en la mitocondria a lo largo del día– es la amenaza que esto supone para el ADN mitocondrial (Raha y Robinson, 2000) (Figura 6), que resulta ser particularmente susceptible a la acción de dichos radicales, por razones que se comentan en el capítulo de este libro que hace referencia a la reparación del ADN dañado.
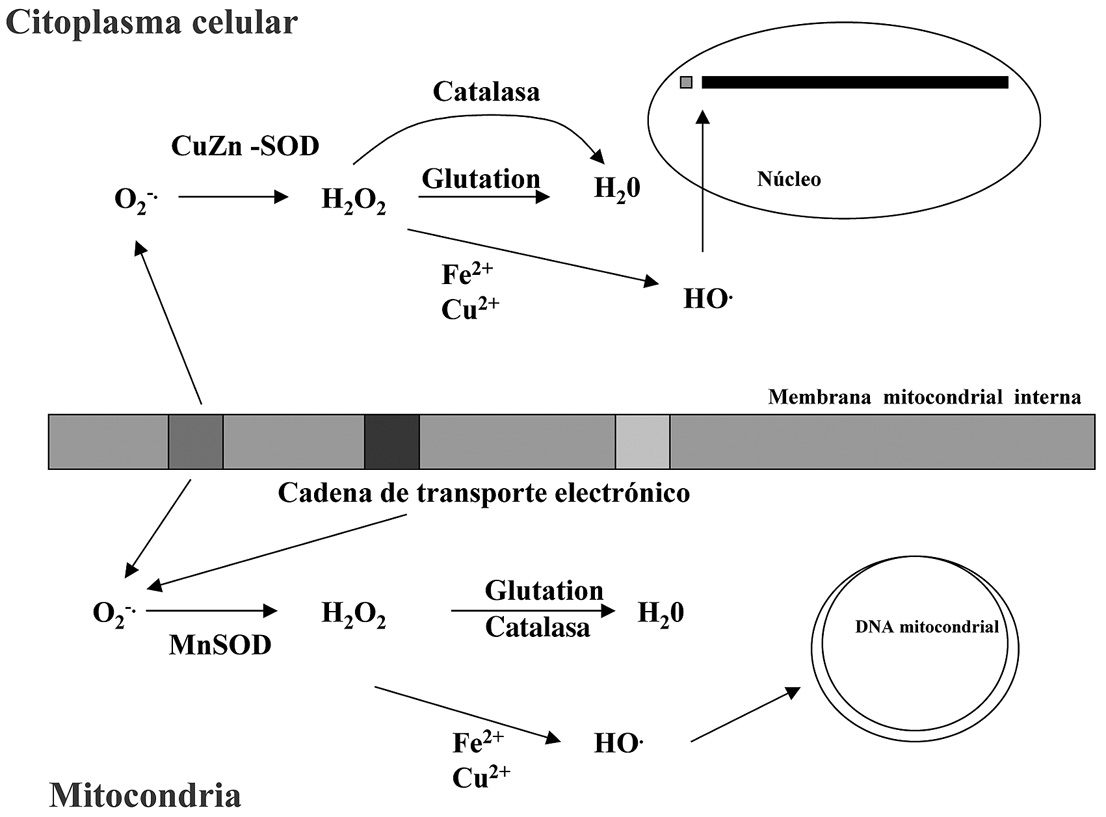
Figura 6. Producción de radicales superóxido por la cadena de transporte de electrones mitocondrial y gestión de los mismos en la matríz mitocondrial y en el citoplasma celular.
La presencia casi permanente de radical superóxido en seres de vida aerobia hace que todos ellos tengan en sus células un tipo de enzimas dedicadas a “desactivar” ese radical, estas enzimas aparecen tanto en procariotas como en eucariotas. Teniendo en cuenta lo arriba expuesto no resulta extraño que se asociase la restricción calórica con la disminución de radicales libres en la mitocondria, y con ello una menor exposición de la célula al estrés oxidativo (Sohal y Weindruch, 1996), no obstante es pronto para dar por segura tal relación ya que todavía se desconocen los mecanismos precisos que relacionan la limitación calórica en la dieta con el envejecimiento (Guarente y Picard, 2005).
7.4.2.5 Producción de radicales de oxígeno por células fagocíticas
Como se ha podido comprobar en los casos anteriores, los radicales de oxígeno se generaban como subproductos no deseados de ciertos procesos metabólicos, pero algunas células producen estas sustancias con fines específicos, tal es el caso de la producción de radicales superóxido por las células fagocíticas (macrófagos, polimorfonucleares). Este tipo de células tienen, entre otras, una misión defensiva, utilizando para ello toda una serie de mecanismos agresivos contra agentes extraños, uno de estos consiste en generar radical superóxido a partir del O2 gracias a un complejo enzimático ubicado en la membranas que toma electrones del NADPH y los transfiere al oxígeno, el balance neto del complejo proceso se representa en la Figura 7.
![]()
Figura 7. Producción de radicales superóxido en la reacción de oxidación del NADPH por la NADPH-oxidasa.
Dada la baja toxicidad que el radical superóxido tiene en el caso de los microorganismos, se piensa que lo que en realidad los daña es algún radical derivado del superóxido, como el OH., que resulta ser mucho más tóxico que el anterior. En la formación del radical hidroxilo intervendrían metales pesados y H2O2 producido este en la reacción de la superóxido dismutasa (SOD) con el radical superóxido. Esta reacción resultaría beneficiosa para las funciones de defensa frente a agentes extraños mientras permanezca controlada, pero en algunos casos parte de las moléculas oxidantes escapan al exterior de la célula, y en determinadas condiciones pueden dañar tejidos adyacentes tras la formación de radicales hidroxilo. Se postula que en este caso jugarían un importante papel iones de hierro presentes en el medio extracelular, aunque la cantidad de este elemento en fluidos orgánicos, que no esté unido a lactoferrina o transferrina, es inapreciable en condiciones normales, no obstante el hierro podría proceder del elemento fagocitado. En este sentido la capacidad de los asbestos para inducir transformación maligna de células se piensa que es debida al hierro que contienen, de tal forma que este reaccionaría con el H2O2 que procede del radical superóxido (producido por las células fagocíticas presentes en el pulmón) para generar radical hidroxilo, dañando así tejidos adyacentes.
7.4.2.6 Síntesis del óxido nítrico
Otro de los radicales libres de interés en medicina es el NO. (Figura 8). Este compuesto gaseoso se forman en un proceso que parte de la L-arginina y es catalizado por un tipo de enzimas denominadas genéricamente como Sintetasas del Óxido Nítrico (SON). El NO. se puede producir en diferentes tejidos donde los distintos tipos de SON se producen en función de las circunstancias del entorno celular, aunque los tejidos mejor estudiados en este sentido son: el endotelial y el nervioso, además, los macrófagos activados pueden producir elevadas concentraciones de NO..
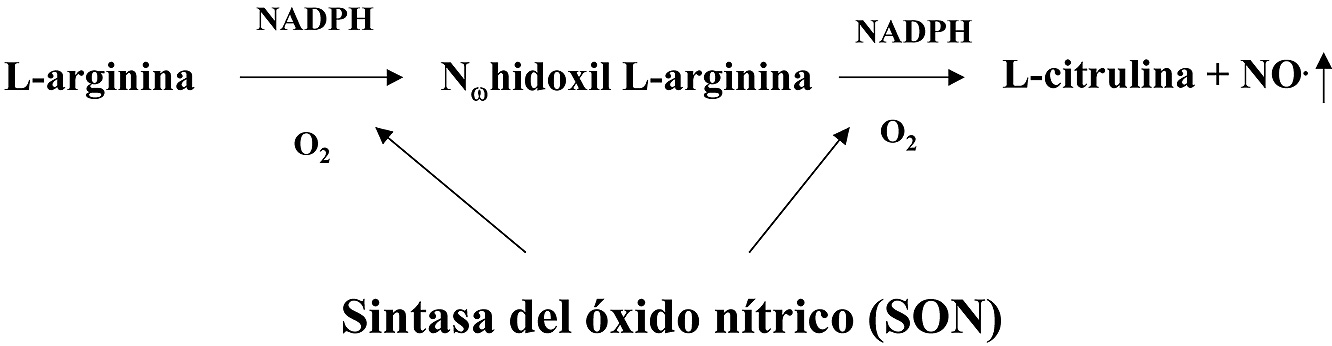
Figura 8. Producción de NO. a partir de la L-arginina.
El NO. tiene un electrón desapareado en su molécula por lo que está considerado como radical libre, aunque su actividad química en lo que respecta a la interacción con la mayoría de las biomoléculas es baja (lo mismo que ocurre con el O2.-). El papel fisiológico del NO. en el ser humano se explica en gran medida por su afinidad por átomos de hierro presentes en el grupo hemo de numerosas enzimas, incluidas las SON que poseen un grupo hemo en su composición. La unión del NO. al átomo de hierro del grupo hemo es reversible e inactiva la acción de la enzima también de forma reversible, participando de esta forma el NO. en la regulación de determinados procesos enzimáticos.
La química del NO. y sus derivados es compleja ya que depende en gran medida del entorno molecular en el que se encuentre, por esta razón hay muchas facetas fisiológicas atribuidas a dicha sustancia que han de ser estudiadas más a fondo, sobre todo en lo referente a su posible efecto adverso sobre las biomoléculas, contexto este que resulta de particular interés teniendo en cuenta el objetivo de este capítulo.
En este sentido la participación del NO. en procesos degenerativos no está del todo comprobada, pero hay evidencias suficientes para suponer una posible relación causa efecto en patologías tales como: enfermedad de Parkinson, Alzheimer, esclerosis lateral amiotrófica, etc., (Torreilles et al., 1999). En todos estos casos la acción del NO. sería indirecta, dada su baja reactividad con biomoléculas, siendo entonces un derivado de este denominado “anión peroxinitrito” (OONO-) el verdadero agente oxidante. En el organismo el OONO- se puede formar por la reacción entre el NO. y el O2.- según el proceso que aparece en la Figura 9.
![]()
Figura 9. Formación de peroxinitrito a partir de óxido nítrico y radical superóxido.
El peroxinitrito es un agente de fuerza oxidante similar a la del OH., sus efectos sobre biomoléculas son diversos: protonaciones, consumo de agentes antioxidantes celulares, oxidación de grupos –SH, oxidación de lípidos, nitración de aminoácidos aromáticos, nitración y desaminación de bases nitrogenadas en el ADN, rotura del dúplex de ADN, etc. Se piensa que algunos de estos efectos no son consecuencia directa del peroxinitrito sobre las biomoléculas, sino de derivados del mismo, tales como el nitrosoperoxicarbonato (O=N-OOCO2-) producido al reaccionar con el CO2 presente en los tejidos.
Podemos decir que la presencia de NO. en un entorno celular donde se produzca O2. daría lugar a la producción de peroxinitrito que dañaría las biomoléculas, induciendo con ello alteraciones funcionales y estructurales en las proteínas, así como daños en las membranas y mutaciones en el ADN que tendrían su manifestación más patente en diversos procesos degenerativos asociados o no al envejecimiento. No obstante resulta difícil establecer por el momento la incidencia real de los derivados del NO. en el envejecimiento.
7.4.2.7 Radiaciones U.V.
A pesar de que las radiaciones U.V. del espectro solar que alcanzan la superficie de la tierra no tienen energía suficiente para ionizar las moléculas de agua, al incidir aquellas sobre el H2O2 producen radicales hidroxilo (Figura 10).
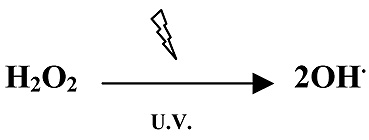
Figura 10. Formación de radical hidroxilo a partir de peróxido de hidrógeno en presencia de radiación U.V.
Esta capacidad varía con la longitud de onda de la radiación, siendo más acusado este efecto a longitudes de onda más cortas. Conviene tener presente esta circunstancia a la hora de estudiar las mutaciones en tejidos expuestos a la acción de los rayos solares. En este caso el desencadenante de la producción de los radicales, aunque exógeno (U.V.), estaría favoreciendo la formación de radicales endógenos. Además es probable que por este mecanismo se generen muchas de las mutaciones que afectan al tejido epitelial si tenemos en cuenta la casi permanente presencia de H2O2 en las células.
7.4 Papel de los metales de transición en la formación de radicales libres de alta toxicidad
Como se comentó en otros apartados, parece evidente que frente a muchas biomoléculas, tanto el radical superóxido como el peróxido de hidrógeno no presentan una elevada toxicidad por sí mismos (al igual que ocurre con el O2), por lo que estas sustancias actuarían en la mayoría de los casos como precursores de otras moléculas bastante más agresivas para el entorno celular, como es el caso del radical hidroxilo, frente al que no existe –en principio– sistema enzimático específico de desintoxicación como la SOD para el radical superóxido o la catalasa en el caso del peróxido de hidrógeno ( aunque antioxidantes menos específicos tales como el glutation reducido sí parece que pueden inactivarlo). La vía más común de formación de este radical en los seres vivos se cree que es la reacción de peróxido de hidrógeno con metales de transición tales como el hierro o el cobre, este proceso se conoce como reacción de Fenton y se resume de la manera siguiente (Figura 11):

Figura 11. Producción de radicales hidroxilo por reacción de Fenton.
Para que la reacción de Fenton se lleve a cabo se necesitan iones ferrosos en el medio. En general se puede decir que tanto en el interior de la célula como en los fluidos corporales no existe hierro libre en condiciones normales, ya que una característica bien conservada a lo largo de la evolución, tanto en procariotas como en eucariotas, es la precisa regulación de la expresión genética de fenotipos asociados al control de la concentración intracelular de hierro, por lo que el riesgo de formación de radicales hidroxilo estaría considerablemente disminuido (Sullivan, 2004). Además –como ya se ha comentado– existen en el organismo sistemas para la neutralización del peróxido de hidrógeno, cuya eliminación reduce el riesgo de formación de radical hidroxilo. No sería extraño pues que algunos de los procesos degenerativos asociados a alteraciones en el metabolismo del hierro o daños tisulares en órganos con alto contenido en este metal, estuviesen relacionados con la presencia de radicales libres generados en la reacción de Fenton.
Aunque individuos con una sobrecarga crónica de hierro no suelen presentar manifestaciones clínicas evidentes hasta una edad avanzada (aunque el estilo de vida condiciona la aparición de los síntomas, más frecuentes en los varones), cuando estos aparecen afectan, sobre todo, a tejido hepático y corazón como ocurre en el caso de la hemocromatosis. Otro ejemplo de patología originada por una alteración de los niveles de hierro es la ataxia de Friedreich. En esta enfermedad el individuo sufre alteraciones del sistema nervioso, así como disfunciones cardiacas, y la expectativa de vida es muy reducida. En este caso se sabe que el gen mutado codifica una proteína ubicada en la mitocondria, la frataxina. Mediante un mecanismo todavía no bien comprendido el déficit de esta proteína induce elevadas concentraciones de hierro en la mitocondria, donde es habitual la presencia de RLO (Cavadini et al., 2000).
A la vista de lo expuesto cabe considerar la posibilidad de que muchas de las patologías asociadas a sobrecarga crónica de hierro se produzcan por intervención de RLO formados al reaccionar el hierro con el peróxido de hidrógeno. Como se comentó en un apartado anterior, el hierro puede participar en reacciones de óxido-reducción de algunos tipos de biomoléculas. Algunos de estos procesos tienen lugar en zonas del sistema nervioso central con contenido elevado en hierro. En estas reacciones se pueden producir RLO que actuarían como desencadenantes del daño molecular (Zecca et al., 2004). Son pocos los estudios realizados sobre la relación del hierro con el envejecimiento, no obstante, sí se ha podido comprobar esta relación en estudios utilizando invertebrados como modelo. En lo referente a vertebrados se observa que los niveles de 8OHdG (marcador del daño óxidativo en ADN) aumentan con los de ferritina en suero.
7.5 ¿En qué forma afectan los radicales libres a las biomoléculas?
En general, dada la reactividad de algunos de los RLO y RLN, son muchas las biomoléculas susceptibles de ser dañadas (Figura 12) (hay que tener en cuenta que las biomoléculas son especies químicas altamente reducidas, por lo que son una fuente importante de electrones para los radicales libres).
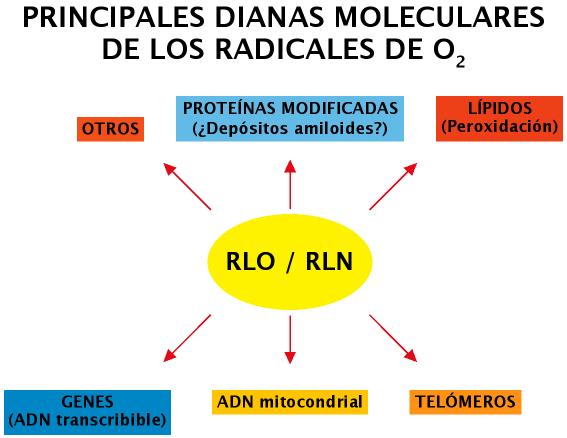
Figura 12. Dianas Moleculares de RLO y RLN.
Algunos ejemplos de este fenómeno serían: la peroxidación de ácidos grasos insaturados, modificaciones en el ADN (alteraciones de las bases nitrogenadas, rotura de hebras, intercambio de cromátidas, establecimiento de enlaces cruzados con proteínas del entorno, etc.) (Zglinicki et al., 2001. Hasty y Vijg, 2002). Las proteínas pueden ser oxidadas en regiones adyacentes a puntos de unión de metales de transición o sufrir pérdida de grupos sulfhidrilo (R-SH), etc. Las cadenas laterales de aminoácidos tales como: cisteína, arginina, prolina, histidina, lisina y tirosina son particularmente susceptibles, formándose grupos aldehídos o cetonas por oxidación, además pueden formarse enlaces cruzados intra o intercatenarios. Estas modificaciones en general justificarían una pérdida de función, y en la mayoría de los casos la degradación proteolítica de la molécula afectada (Figura 13). No pocas proteínas modificadas por efecto de los radicales libres adoptan conformaciones resistentes a la degradación, pudiendo producirse entonces una acumulación de las mismas. Tal vez sea este el origen de algunas enfermedades.
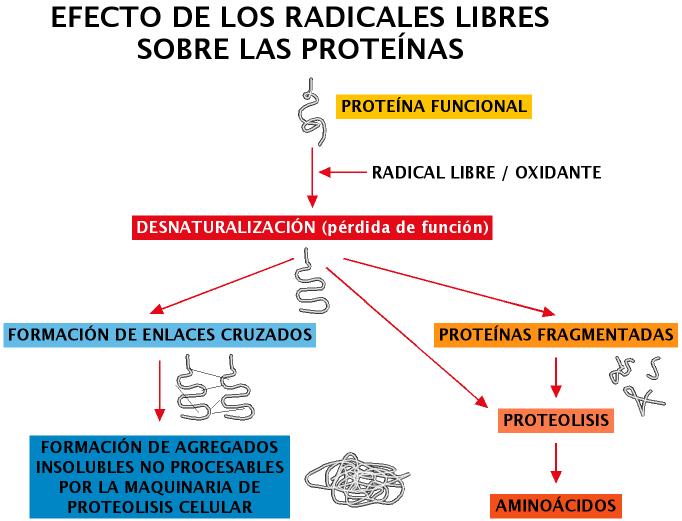
Figura 13. Efecto de ROS sobre proteínas.
En general se aprecia un incremento considerable de daños en biomoléculas a medida que aumenta la edad del individuo, además el daño inducido en las mismas por los derivados del oxígeno parece no limitarse a tejidos concretos (aunque podría variar su intensidad en función del tejido que se considere) y crece exponencialmente con la edad. La repercusión fenotípica de los daños en el ADN son de particular importancia por el hecho de que si estos permanecen sin reparar se origina una mutación estable. En lo que respecta a las células somáticas conviene recordar que lo que origina la transformación de una célula normal a tumoral es, en último término, una cadena de eventos mutacionales y/o modificaciones epigenéticas.
7.6 ¿Cómo se defiende la célula frente a los radicales libres?
A la vista de lo expuesto en párrafos anteriores parece evidente que los seres vivos que habitan en ambientes donde está presente el O2 están expuestos de manera casi permanente a concentraciones variables de agentes tóxicos derivados de ese gas, por lo que se puede asumir que el nivel de alteraciones en las biomoléculas que forman dichos organismos sería probablemente incompatible con la vida si no fuera por la existencia de mecanismos que neutralizan dichos tóxicos (Figuras 14, 15 y 16). En muchos casos estos mecanismos se han conservado a lo largo de la evolución, circunstancia esta que evidencia la importancia de los mismos para la célula; tal es el caso de enzimas como las SOD y la catalasa (Figura 15), que inactivan el radical superóxido y el peróxido de hidrógeno respectivamente.
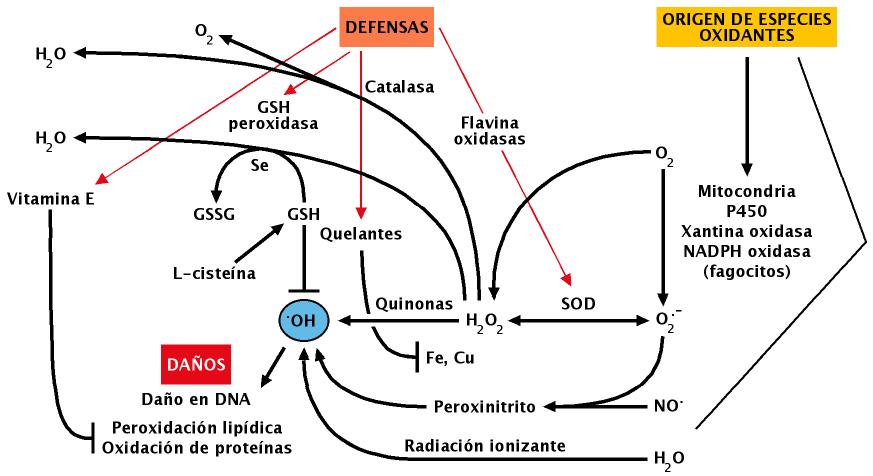
Figura 14.
Las superoxido dismutasas (SOD) son metaloenzimas antioxidantes que catalizan la dismutación del radical superóxido. En la naturaleza se conocen al menos cuatro tipos de SOD (Fridovich, 1995), todas ellas tienen átomos metálicos en su centro activo, y se diferencian por el metal que tienen en su grupo prostético: Cu/Zn, Ni, Fe ó Mn, las dos últimas están presentes en todos los reinos de la naturaleza y se localizan en diferentes compartimentos celulares. En humanos hay dos tipos de SOD, el primero se localiza en el citoplasma celular y en su grupo prostético presenta átomos de Cu y Zn (se conoce además una forma extracelular de SOD Cu/Zn), mientras que el segundo tipo se localiza en la mitocondria y tiene Mn, lo que estaría de acuerdo con su supuesto origen procariótico.
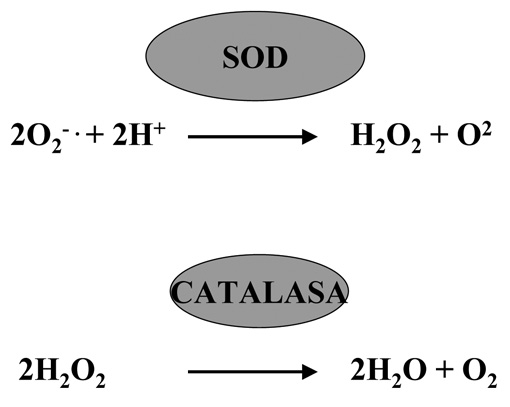
Figura 15.
La concentración de SOD en la célula ha de estar perfectamente controlada, ya que su disfunción puede desorganizar la respuesta celular contra el estrés oxidativo. En este sentido tanto el exceso como el déficit de la enzima se asocian a procesos patológicos (parte de la sintomatología presente en la trisomía 21 se cree debida a un exceso de actividad de SOD, mientras que en la esclerosis lateral amiotrófica está en defecto). Por esta razón hay que ser cautos a la hora de proponer tratamientos con este tipo de enzimas dada la complejidad del los procesos biológicos en los que interviene de forma indirecta (entre ellos la respuesta al estrés oxidativo). La catalasa es una enzima que se encuentra presente en todos los reinos de la naturaleza, es una oxidoreductasa del H2O2 debido a esta actividad transforma el peróxido de hidrógeno en agua y oxígeno molecular (Figura15).
Podemos decir que estos mecanismos son específicos, por cuanto que tienen sustratos también específicos, no obstante hay sistemas de desintoxicación menos específicos –aunque no por ello menos eficientes–. Este sería el caso de moléculas orgánicas de pequeño tamaño tales como el glutation, un tripéptido (ac.glutámico-cisteína-glicina) que interviene en numerosas reacciones de óxido-reducción. En él la parte que se oxida son los grupos tiólicos (R-SH) de la cisteína. El glutation inactiva sobre todo H2O2 y además actúa sobre hidroperóxidos orgánicos (R-O-O-H), haciéndolos menos tóxicos y más solubles, por lo que contribuye a la “desintoxicación” con intervención de la glutation peroxidasa. El paso de glutation oxidado (glutation-S-S glutation) a glutation reducido (glutation-SH) lo cataliza la glutation reductasa que toma los electrones del NADPH (Figura 16). La glutation peroxidasa contiene un átomo de selenio, por ello se considera que, en este sentido, el selenio favorece indirectamente la defensa antioxidante del organismo. La eliminación del H2O2 en los diferentes tejidos se lleva a cabo tanto por el glutation reducido como por la catalasa, aunque la contribución de cada uno de los sistemas está sometida a fluctuaciones en función del tipo de tejido y de otros factores.
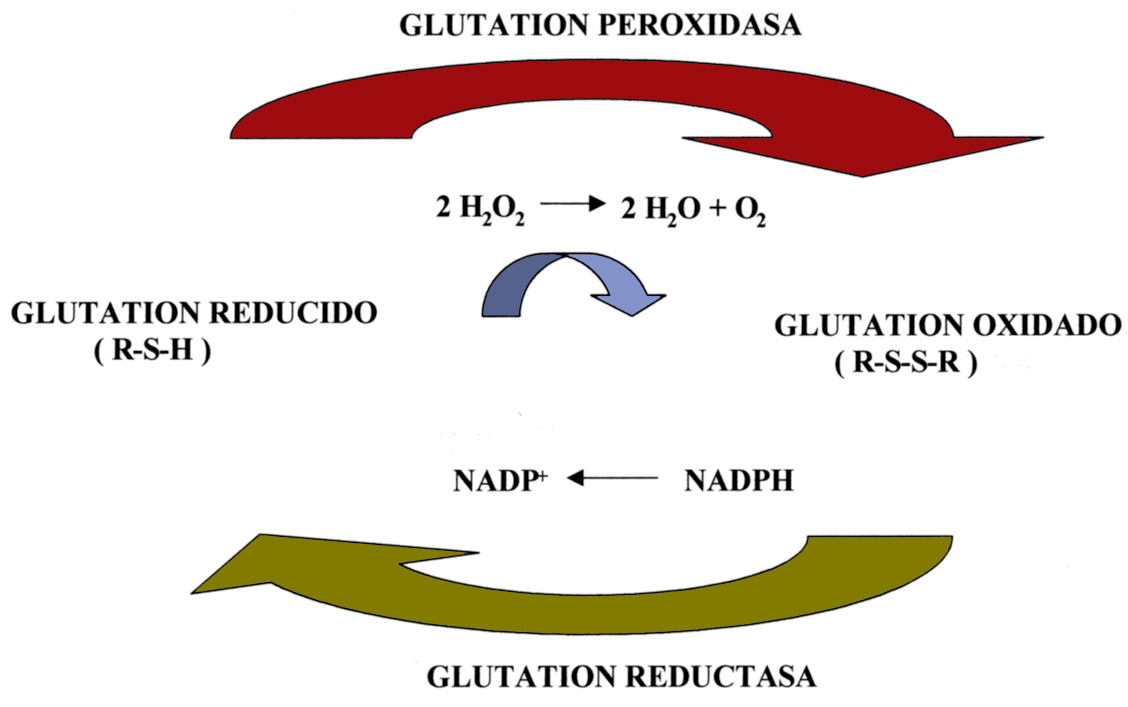
Figura 16. Ciclo de óxido-reducción del glutation.
Otras sustancias que se cree son utilizadas por la célula para combatir el estrés oxidativo serían: vitaminas C y E, flavonoides, carotenos, etc., y tal vez el ácido úrico. Por extensión podemos decir que las proteínas o moléculas que “secuestran” hierro (en forma libre o formando parte del “hemo”) o cobre, actuarían de protectores frente al estrés oxidativo, al impedir la participación de dichos elementos en la formación de radicales libres en la reacción de Fenton.
En general un buen antioxidante ha de actuar a bajas concentraciones y, por supuesto, impedir la oxidación de un elevado número de sustratos diferentes. No todos los antioxidantes tienen un comportamiento óptimo en todos los ambientes ni ante todos los sustratos, por lo que cabe pensar que diferentes sistemas de desintoxicación actuarían con distinta eficiencia en tejidos ó compartimentos celulares diferentes, solapándose en muchos casos sus efectos. A pesar de los numerosos estudios llevados a cabo sobre el papel de los antioxidantes en el envejecimiento, la única evidencia de una relación causa-efecto in vivo se ha obtenido en ensayos con invertebrados, por lo que resulta aventurado, por el momento, extrapolar conclusiones al caso del ser humano.
Hay que decir que los sistemas antioxidantes (al igual que ocurre con los sistemas de control de hierro intracelular) propios de la célula suelen estar sometidos a un riguroso control de expresión genética, siendo este control altamente sensible a situaciones de estrés oxidativo. En este sentido, una de las hipótesis que se plantean para explicar el fenómeno de la ralentización del envejecimiento por un fenómeno de hormesis (Rattan, 2004), postula que dicho fenómeno se debería a un hipotético proceso de adaptación previa y progresiva que prepararía a las células u organismos sometidos a determinados estímulos para una situación de estrés oxidativo. En este caso la célula presentaría niveles adecuados de enzimas “desintoxicantes” como las SOD y la catalasa, así como mecanismos reparadores de daños a ADN y proteínas, encontrándose de esta forma preparada para responder a un incremento de oxidantes en el entorno.
7.7 Especies oxidantes derivadas del oxígeno y enfermedad
En la bibliografía médica se encuentran casos en los que se asocian radicales libres a enfermedad (Halliwell y Gutteridge, 1990), aunque de esta asociación no siempre se pueda concluir de manera clara en qué casos los radicales libres son la causa del problema o derivan del mismo, ya que en muchos de ellos los daños tisulares suelen ir acompañados de estrés oxidativo, lo que generaría una situación de fenómeno autosostenido o de reacción en cadena. La labor pendiente en este campo de estudio es considerable, y depende de la disponibilidad de análisis específicos que detecten la presencia de radicales libres y sus efectos in vivo. A pesar de los avances en este sentido, se puede decir que queda aun un largo camino por recorrer hasta que se disponga de evidencias esclarecedoras sobre la relación causa-efecto entre radicales libres y enfermedad, dada la dificultad que tiene la interpretación de resultados obtenidos en sistemas complejos o ensayos in vivo.
En la Tabla 1 se citan algunas de las patologías que se han asociado con la presencia de RLO en el entorno del tejido u órgano afectado. En la mayoría de los casos, como ya se comentó, no hay evidencia de que aquellos sean los agentes causantes, ya que muchos de ellos aparecen como consecuencia de un daño tisular previo, una vez que aparecen podrían causar alteraciones, si los sistemas de neutralización de los que dispone el organismo no intervienen en el momento adecuado ni con la potencia requerida.
|
Cáncer Enfermedades Cardiovasculares Enfermedades Neurodegenerativas Diabetes Enfermedades asociadas a procesos inflamatorios Depósitos de biomoléculas no procesables |
Tabla 1.
Uno de los ejemplos más representativos de los efectos nocivos del estrés oxidativo lo tenemos en los individuos con déficit de glucosa 6-fosfato deshidrogenasa, esta circunstancia provoca una deficiencia de NADPH en las células, por lo que la desintoxicación de H2O2 via glutation no funciona correctamente, produciéndose entonces estrés oxidativo al aumentar las concentraciones intracelulares de peróxido de hidrógeno. Cuando este acúmulo tiene lugar dentro del eritrocito, la elevada concentración de hierro en el mismo puede agravar la situación al producirse radical OH. por reacción de Fenton. Esta situación se complica por la presencia de agentes xenobióticos generadores de estrés oxidativo, como en el caso de ciertos herbicidas o antimaláricos. Un caso similar sería el déficit de la glutation peroxidasa dado su papel en el mecanismo de desintoxicación mediado por el glutation.
El déficit en SOD se asocia a casos de esclerosis lateral amiotrófica en individuos heterozigóticos, mientras que una sobreproducción de la misma se cree que es la causa de parte de la sintomatología que acompaña al síndrome de Down. En otro caso la asociación del cáncer de pulmón por asbesto y otro material particulado parece estar relacionada con su contenido en hierro, por lo que el mecanismo de daño en este caso podría involucrar radicales hidroxilo producidos por una reacción de Fenton (Weinberg, 1999), en la que el aporte de peróxido de hidrógeno provendría de la reducción del radical superóxido generado en el ataque fagocítico a la partícula de mineral inhalada. La ataxia de Friedreich, ya comentada en otro apartado, se puede considerar como una de las enfermedades en las que, con toda probabilidad, intervengan ROS. Los fenómenos que acompañan a los casos de isquemia conducen a una situación de estrés oxidativo, que resulta perjudicial para el tejido. En general, aunque existe una larga lista de procesos patológicos con posible relación con RLO, en muchos de ellos no se ha podido esclarecer aún el papel de dichas sustancias en los mismos.
En líneas generales se puede decir para los radicales libres, lo mismo que para cualquier agente mutagénico, su acción depende tanto de la intensidad como de la duración del estrés (sin olvidar la presencia de mecanismos antioxidantes que se opondrían a dicho estrés), idea que explicaría el incremento de fenómenos mutacionales a lo largo de la vida del individuo. En lo que se refiere al tipo de gen mutado hay que decir que probablemente las peores mutaciones sean aquellas que afecten a genes cuyos productos participen en fenómenos de regulación de la expresión genética relacionados con la respuesta al estrés oxidativo, debido a que podrían alterar la expresión de más de un gen (efecto pleiotrópico).
7.8 ¿Cómo retrasar el envejecimiento?
Al principio de este capítulo definíamos el envejecimiento como un fenómeno irreversible, por lo que cualquier tipo de abordaje en este campo ha de tener en cuenta esta circunstancia (en muchos casos lo que se considera una “reversión” del envejecimiento no suele pasar de un fenómeno meramente “cosmético”). Por ello, el planteamiento más razonable será el de conocer la forma en la que podemos retrasar este proceso o de reconducirlo de una manera equilibrada, de tal forma que el inevitable deterioro sea lo más homogéneo y lento posible, a fin de evitar desequilibrios importantes de la homeostasis orgánica. El proceso parece tan complejo que hace pensar que todavía estamos lejos de encontrar elixires o prácticas que prolonguen mucho más las expectativas de vida del ser humano (tomando como referencia la de países desarrollados), o que ralenticen de manera efectiva el proceso de envejecimiento. No obstante, el conocimiento en esta rama de la biología avanza de manera considerable, por lo que no hay que descartar logros importantes a medio plazo. En este sentido podemos citar los resultados obtenidos en ensayos con invertebrados en los que se ha conseguido prolongar la longevidad incrementando la síntesis, por parte de las células, de enzimas inactivadoras de derivados tóxicos del oxígeno. Existe además una clara relación entre la restricción calórica y longevidad (Merry, 2002, Reverter-Branchat et al., 2004) pero carecemos de un modelo que relacione de una forma evidente ambos fenómenos. Conoceremos más sobre las posibilidades de estas estrategias cuando comprendamos de manera más precisa los mecanismos moleculares que gestionan la utilización de la energía y metabolitos proporcionados por los nutrientes. Además no hay que olvidar que un mejor conocimiento de nuestro genoma ayudará a conocer también las particularidades de cada individuo de cara a conocer su capacidad para gestionar los daños moleculares que se producen de forma permanente en sus células y poder así tomar las oportunas medidas preventivas.
Mientras se descifran los mecanismos moleculares que conducen a la senescencia parece que lo más razonable sería actuar sobre el ambiente, modificando convenientemente hábitos de vida (dieta equilibrada y baja en calorías, ejercicio moderado, reducción del estrés en todas sus variedades, etc.) de tal forma que, más que prolongar la longevidad, lo que se logre sea que el individuo alcance esta en las mejores condiciones de salud. A este respecto cabe destacar un interesante estudio llevado a cabo en humanos y en el que se relaciona estrés psicológico con daño en el genoma. Las conclusiones del estudio apuntan a un incremento del estrés oxidativo paralelo al psicológico. Como consecuencia de dicho estrés oxidativo se incrementaría la tasa de daños inducidos por estos en el ADN con el consiguiente riesgo de transformación celular maligna, (Sapolsky, 2004, Eppel et al., 2004). Resulta pues interesante este nuevo abordaje experimental que permite establecer un mecanismo fisiológico-molecular para un fenómeno tan interesante en sanidad como es la relación entre fenómenos psicológicos y somáticos, tal vez sea este un campo de estudio que en el futuro aporte datos de interés de cara a una estrategia de ralentización del envejecimiento.
7.9 Conclusión
No perdiendo nunca de vista la gran complejidad del fenómeno, en lo que se refiere a su origen y manifestaciones fenotípicas, hemos analizado una de las teorías que pretenden explicar las causas del envejecimiento. Numerosas evidencias experimentales sugieren que el daño en biomoléculas inducido por RLO es un hecho frecuentemente asociado a la senescencia, y probablemente una de las causas importantes de la misma. La permanente presencia de aquellas sustancias en diferentes compartimentos celulares –donde pueden reaccionar con biomoléculas del entrono– hace más probable la hipótesis. Por otra parte no hemos de olvidar el papel crucial que juegan algunos metales en el desencadenamiento del estrés oxidativo. Por esta razón la célula mantiene en todo momento un estricto control en la expresión de los genes involucrados en el metabolismo del hierro (el elemento metálico más abundante y de distribución más amplia en el organismo) y enzimas neutralizantes de RLO, a fin de evitar que ambas especies interaccionen para formar el radical OH., el más tóxico para la célula.
A pesar de los datos aportados en esta revisión, que proponen a las especies reactivas del oxígeno y del nitrógeno como activos promotores del envejecimiento, desconocemos en que medida participan en el mismo. No obstante, aunque no se dispone de sistemas analíticos que nos permitan aclarar este punto con una mayor precisión, hay datos obtenidos por métodos lo suficientemente sensibles y específicos que evidencian una relación RLO/RLN-envejecimiento. Entre las cuestiones por resolver está la que se refiere a las moléculas diana de las especies oxidantes in vivo, por el momento se desconoce si hay blancos preferentes o el ataque es indiscriminado, pero suponemos que a la hora de considerar la diana del ataque hay que asumir que casi todas las biomoléculas serían susceptibles de ser alteradas por tales sustancias, y que la probabilidad de alteración estaría sujeta a variables tales como: proximidad en el espacio de los agentes reaccionantes y a que la interacción entre los mismos esté termodinamicamente favorecida en el entorno celular donde se desarrolle el proceso.
Por último decir que cualquier estrategia que tenga por objeto el ralentizar el envejecimiento ha de plantearse desde el conocimiento del origen del fenómeno, su localización espacial y su cuantificación. Aún así hay que tener en cuenta que los seres vivos son entes sumamente complejos, en los que se dan sofisticados sistemas de control que todavía desconocemos, y por ello los resultados de ensayos obtenidos utilizando partes de un organismo (ensayos in vitro) no son extrapolables al organismo entero (ensayos in vivo), como tampoco lo han de ser los obtenidos al utilizar especies diferentes (gusano, mosca, mamífero). En otro orden de cosas, y para esclarecer el mecanismo de senescencia, resulta de sumo interés el estudio del envejecimiento en los organismos obtenidos por clonación, ya que su material genético se ha tomado de una línea celular diferenciada de un individuo adulto. Este genoma ha de dirigir la formación de un nuevo ser en todas sus etapas, por lo que la calidad de la copia del genoma se verá reflejada en el fenotipo de los clones, circunstancia esta que permitirá sacar conclusiones sobre el nivel de envejecimiento del material genético utilizado en el ensayo de clonación. Hoy en día y dado el auge de los ensayos de clonación en diversas especies animales se dispone de numerosos datos al respecto, pero no son todavía concluyentes.
Referencias
- Balaban R. S., Nemoto S., Finkel T. Mitochondria, oxidants and aging. Cell. 2005;4:483-497.
- Cavadini P., Gellera C., Patel P. I., Isaya G. Human frataxin mantains mitochondrial iron homeostasis in Saccharomyces cerevisiae. Hum. Mol. Genet. 2000;9:2523-2530.
- Eppel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc. Natl. Acad. Sci. U S A. 2004;101:17 312-17315.
- Finkel T., Holbrook N. J. Oxidants, oxidative stress and the biology of ageing. Nature. 2000; 408:239-247.
- Fridovich I. Superoxide radical and superoxide dismutase. Ann. Rev. Biochem. 1995;64: 97-112.
- Guarente L., Picard F. Calorie Restriction- the SIR2 connection. Cell. 2005;120:473-483.
- Halliwell B., Gutteridge J. M. C. Role of free radicals and catalytic metal ions in human disease: an overview. 1990; Methods in enzymology. 186, 1-85. Academic Press. New York. 1990.
- Halliwell B., Gutteridge J. M. C. Free radicals in biology and medicine. Halliwell B. and Gutteridge J. M. C (eds.) Oxford University Press. Oxford.1999.
- Harman D. Aging: A theory based on free radical and radiation chemistry. J. Gerontol. 1956;11:298-300.
- Hasty P., Vijg J., Genomic Priorities in Aging. Science. 2002;296:1250-1251.
- Irie M., Asami S., Ikeda M., Kasai H. Depressive state relates to female oxidative DNA damage via neutrophil activation. Biochem. Biophys. Res. Commun. 2003;311:1014-1018.
- Johnson F. B., Sinclair D. A. , Guarente L. Molecular biology of aging. Cell. 1999;96:291-302.
- Melov S., Ravenscroft J., Malik S., Gill M. S., Walker D. W., Clayton P. E., Wallace D. C., Malfroy B., Doctrow S. R., Lithgow G. J. Extension of life-span with superoxide dismutase/catalase mimetics. Science. 2000;289:1567-1569.
- Merry B. J. Molecular mechanisms linking calorie restriction and longevity. Int J. Biochem. Cell. Biol. 2002;34:1340-1354.
- Raha S., Robinson B. H. Mitochondria, oxygen free radicals, disease and ageing. Trends Biochem. Sci. 2000;25:502-508.
- Rattan S. I. Aging, anti-aging, and hormesis. Mech. Ageing Dev. 2004;125:285-289.
- Reverter-Branchat G., Cabiscol E., Tamarit J., Ros J. Oxidative damage to specific proteins in replicative and chronological-aged Saccharomyces cerevisiae: common targets and prevention by calorie restriction. J. Biol. Chem. 2004;279:31983-31989.
- Riere Codina M. El oxígeno y la evolución. Mundo científico. 2002;238:66-71.
- Sapolsky R. M. Organismal stress and telomeric aging: an unexpected connection. Proc Natl. Acad. Sci. U S A. 2004;101:17323-17324.
- Sohal R. S., Weindruch R. Oxidative stress, caloric restriction and aging. Science. 1996;273:59-63.
- Sullivan J. L. Is stored iron safe? J. Lab. Clin. Med. 2004;144:280-284.
- Terman A., Brunk U. T. Aging as a catabolic malfunction. Int. J. Biochem. Cell Biol. 2004 ;36:2365-23675.
- Torreilles F., Salman-Tabcheh S., Guérin M. C. Neurodegenerative disorders: the role of peroxynitrite. Brain Research Reviews. 1999;30:153-163.
- Weinberg E. D. The development of awareness of the carcinogenic hazard of inhaled iron. Oncol. Res. 1999;11:109-113.
- Zecca L., Youdim M. B., Riederer P., Connor J. R., Crichton R. R. Iron, brain ageing and neurodegenerative disorders. Nat. Rev. Neurosci. 2004;11:863-873.
- Zglinicki T., Bürkle A., Kirkwood T. B. L. Stress, DNA damage an ageing, an integrative approach. Exptl. Geront. 2001;36:1049-1062.