• MC-F-009. Capítulo 9. Envejecimiento y ritmos biológicos.
9.1 Introducción
El envejecimiento es un proceso continuo que comienza con el nacimiento y termina con la muerte. El papel que las alteraciones del sistema circadiano tiene en el proceso de envejecimiento es tan atractivo como difícil de dilucidar. El principal problema radica en discriminar si las alteraciones del sistema circadiano que suelen observarse en los sujetos de edad avanzada, son la causa o la consecuencia del propio proceso de envejecimiento. A lo largo de este capítulo analizaremos los cambios que, dependiendo de la edad, se experimentan en el sistema circadiano y en las funciones por él controladas. Sin embargo, parece conveniente comenzar explicando que entendemos por sistema circadiano y cual es su significado en el contexto de los sistemas de regulación de las funciones vitales (homeostasis).
9.2 Concepto de sistema circadiano
9.2.1 La ritmicidad de las funciones biológicas
La naturaleza rítmica de los fenómenos biológicos es conocida desde la antigüedad. Los griegos habían ya observado que las hojas de ciertas plantas cambiaban de posición durante las horas del día y la noche. Otros fenómenos rítmicos como la estacionalidad reproductora, la migración de las aves o la hibernación en algunas especies animales eran perfectamente conocidos, pero considerados como una simple consecuencia de las acciones de factores ambientales y astronómicos que marcaban su impronta en la actividad de todos los seres vivos.
Consideremos un ser humano y analicemos cualquiera de los parámetros que habitualmente nos sirven para verificar el estado de sus funciones vitales: concentraciones plasmáticas de hormonas, enzimas y electrolitos; presión arterial; temperatura
corporal; fuerza muscular; reflejos neurales; etc. Si el análisis se llevara a cabo a distintas horas a lo largo del día y de la noche, la conclusión sería que los valores de estos parámetros no son constantes, sino que varían dependiendo del momento del ciclo diario en que son analizados, y que los patrones de variación se repiten día a día. Este fenómeno de la ritmicidad se extiende a todos los seres vivos, animales o vegetales, y a todos los niveles de organización (molecular, celular, tisular, orgánica, social, etc.). La constatación de la naturaleza rítmica de las funciones de los seres vivos nos genera una primera cuestión: ¿de qué depende esta ritmicidad diaria de las funciones biológicas?
9.2.2 Naturaleza de los ritmos biológicos
Quizás, si a alguien se le muestran las gráficas de los ritmos diarios de presión arterial (PA) o temperatura corporal (tª), por poner un ejemplo, tras observar que la PA aumenta en las primeras horas de la mañana o que la (tª) disminuye durante la noche, su conclusión podría ser la siguiente: los ritmos de PA y temperatura vienen marcados por la actividad física. Así, durante la noche, con el sueño, la actividad física disminuye y la producción de calor también, con lo que baja la temperatura corporal. Por otra parte, la PA aumenta en las primeras horas de la mañana en respuesta al incremento de la demanda de sangre para los distintos órganos durante la actividad diaria. Esta idea de la naturaleza “inducida” de los ritmos biológicos ha estado presente en la ciencia hasta hace relativamente pocos años. Sin embargo, ya en 1729 Jean Jacques d’Ortous de Mairan, había demostrado que la rotación diaria las hojas del heliotropo (Mimosa pudica), considerada como respuesta a los cambios en la luz solar, persistía aun situando las plantas en el interior de una caja, lejos de la influencia del sol. Esto le llevó a proponer la existencia de un a modo de “reloj interno” en el heliotropo, capaz de regular la rotación diaria de sus hojas, independientemente de los cambios de la luz solar. Pero sus conclusiones no fueron aceptadas por la comunidad científica de la época. Sólo en el siglo XX, a partir de la década de los treinta, la naturaleza endógena de los ritmos biológicos, es decir, que la ritmicidad biológica no es un simple reflejo de los cambios que experimenta el medio externo sino que depende de la existencia de osciladores o “relojes” internos que la marcan, fue universalmente aceptada. El estudio de todos los aspectos relacionados con los ritmos biológicos dio lugar al una nueva rama de la biología, la cronobiología (Cardinali y cols., 1994).
9.2.3 ¿Qué parámetros definen un ritmo biológico?
Es conveniente que nos familiaricemos con la nomenclatura habitualmente utilizada en cronobiología. Aplicamos el término ritmo biológico a toda oscilación, regular en el tiempo, de una variable biológica. Lo caracterizamos por los siguientes parámetros: periodo o frecuencia, amplitud, MESOR y acrofase. Las definiciones de estos parámetros pueden entenderse mejor estudiando la Figura 1.
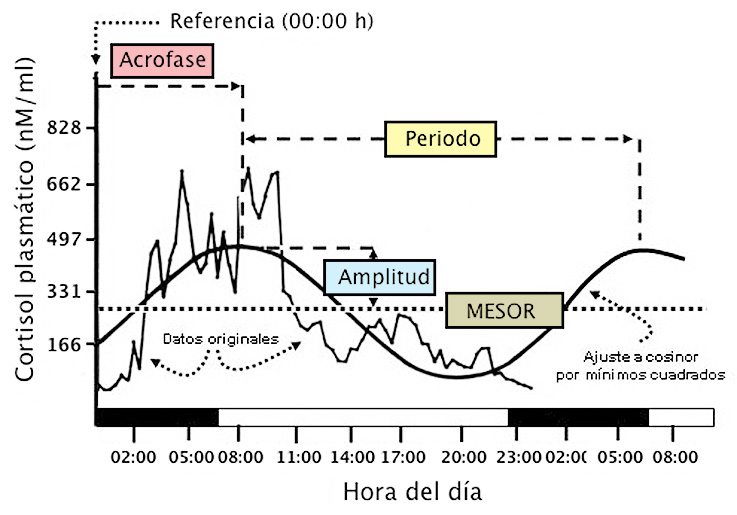
Figura 1. Diagrama en el que, tomando como ejemplo las concentraciones plasmática de cortisol en muestras seriadas de sangre, obtenidas a distintas horas del día (línea poligonal marcada como “datos originales”), se indica como se ajustan a una función cosinoidal (linea curva indicada como “ajuste cosinor por mínimos cuadrados”). Sobre la función cosinoidal resultante del ajuste se indican los parámetros que definen un ritmo biológico: Periodo (tiempo comprendido entre dos valores análogos de la variable ajustada); MESOR (palabra compuesta de las iniciales Midline Estimating Statistic Of Rhythm, es el valor medio de la variable estimado sobre la curva ajustada); Amplitud (diferencia entre el valor máximo de la variable ajustada y el MESOR); Acrofase (tiempo transcurrido entre un punto horario de referencia y el momento en que la variable ajustada alcanza su valor máximo; puede expresarse también en grados, considerando que 24 horas equivaldrían a 360 grados). Modificado de E. Haus y Touitou, 1994.
Toda actividad rítmica es, por definición, continua en el tiempo. Sin embargo, podemos elegir, de manera arbitraria, una hora del día y tomarla como punto de referencia para determinados eventos del proceso rítmico. Habitualmente, se elige como punto de referencia las 12 de la noche (00:00). Así, refiriéndonos, por ejemplo, a la secreción de cortisol (ver Figura 1), que alcanza un valor máximo hacia las primeras horas de la mañana, decimos que la “acrofase” del ritmo de cortisol es a las 08:00 horas, o de 120º (24 horas = 360º), para indicar que la concentración máxima se alcanza 8 horas después de las 00:00 h, o con 120º de retraso con respecto al punto de referencia. Podemos igualmente comparar las acrofases de distintos ritmos y expresar su “relación de fase”. Un ejemplo: la hormona A tiene su acrofase a las 04:00 horas y la B a las 05:00 h. Indicamos este hecho diciendo que la secreción de la hormona B se produce con un “retardo de fase” de 15º (o 1 hora) con respecto a la de A. Podríamos también expresarlo como “adelanto de fase” de A con respecto a B. En condiciones normales, los ritmos circadianos de las distintas variables fisiológicas guardan entre sí y con el medio ambiente (ritmo luz/oscuridad) una relación de fase estable. Decimos entonces que hay una sincronización interna y externa. En determinadas circunstancias como los vuelos transmeridianos o el trabajo nocturno y también como consecuencia del envejecimiento, se produce una situación de desincronización interna y/o externa, con consecuencias negativas sobre la fisiología del sujeto.
9.2.4 Clasificación de los ritmos biológicos
Los ritmos biológicos suelen clasificarse, por su periodo en: circadianos (periodo de aproximadamente 24 horas), ultradianos (periodo con periodo menor de 24 horas) e infradianos (periodo mayor de 24 horas) (Cardinali y cols., 1994).
9.2.5 Características de los ritmos circadianos
Entre todos los fenómenos rítmicos observables en los seres vivos, vamos a centrar nuestra atención en un grupo particular, caracterizado, entre otras cosas, por poseer un periodo de alrededor de 24 horas (duración del día solar), con un rango entre 20 y 28 horas, los nominados por Halberg en 1959 como ritmos circadianos (circa = alrededor). Una de las características fundamentales de los ritmos circadianos es su naturaleza endógena, es decir, que dependen de la existencia de relojes marcapaso internos capaces de generar una actividad rítmica autónoma genéticamente determinada. Para verificar este hecho basta observar cómo tales ritmos persisten en situaciones de ausencia de señales procedentes del medio externo. Un sujeto aislado en una cueva, con temperatura estable y sin signos que le indiquen la alternancia día/noche, sigue presentando ritmos sueño/vigilia con una periodicidad “aproximadamente” igual a la que tenía antes del aislamiento. Hago énfasis en el término “aproximadamente” porque es clave para introducirnos en otra de las propiedades de los ritmos circadianos: la posibilidad de ser sincronizados.
Siguiendo el ejemplo del ritmo sueño/vigilia, cuando nuestro hombre está aislado del medio externo, su periodo no es de 24 horas sino ligeramente mayor (alrededor de 24,5), correspondiente al periodo del marcapasos o reloj endógeno que lo determina. Sin embargo, en condiciones normales, el periodo del ritmo sueño/vigilia es de 24 horas, exactamente la duración del día solar. Esto significa que los ritmos circadianos, pueden ser sincronizados a periodos diferentes del propio del marcapasos endógeno, mediante señales procedentes del medio ambiente. De entre estas señales medioambientales la luz es, sin duda, el factor de sincronización más importante, aunque no el único. Generalmente se utiliza la palabra alemana zeitgeber (dador de tiempos, introducida por J. Aschoff) para designar a cualquier agente capaz de sincronizar ritmos biológicos.
El término ritmo circadiano, es utilizado a veces de manera incorrecta para designar fenómenos cíclicos con periodos muy alejados de las 24 h. Otras veces, la incorrección se produce porque se emplea el término circadiano para ritmos biológicos que, aun teniendo periodos de alrededor de 24 horas, no reúnen los requisitos anteriormente comentados de naturaleza endógena y susceptibilidad de sincronización por factores externos.
De lo explicado anteriormente, puede deducirse que el periodo de un ritmo circadiano resulta de la interacción entre la actividad del marcapasos endógeno y la acción de factores de sincronización. Cuando situamos animales en condiciones de aislamiento del medio externo, la ausencia de zeitgebers hace que se manifieste el ritmo biológico con el periodo propio del oscilador endógeno. En estas condiciones decimos que el ritmo esta en curso libre (free running) y designamos su periodo con la letra grieg tau (t). En presencia de un sincronizador (por ejemplo ciclos luz/oscuridad), el ritmo adquiere el periodo propio del sincronizador, habitualmente designado con la letra “T”. Como regla general, se acepta que en los animales diurnos (entre ellos los seres humanos) el periodo de los relojes endógenos es mayor de 24 horas, mientras que en los nocturnos es menor de 24 horas. En ambos casos, en presencia de las influencias medioambientales los ritmos tienen un periodo T = 24 horas, lo que significa que, en el caso de los animales diurnos, la sincronización introduce un “adelanto” diario del reloj, mientras que lo contrario ocurre en los nocturnos.
9.2.6 ¿Qué entendemos por sistema circadiano?
El conjunto de elementos que controlan los ritmos biológicos de naturaleza circadiana es lo que conocemos como sistema circadiano. Estaría integrado por tres elementos:
- El oscilador endógeno o marcapasos, capaz de generar una señal circadiana (puede no ser único).
- Las vías aferentes al marcapaso, que permitan la llegada al mismo de las señales de sincronización procedentes del medio externo.
- Las vías eferentes desde el marcapaso hacia los efectores que exhiben la ritmicidad circadiana.
9.2.6.1 El reloj o marcapasos endógeno
En los mamíferos, incluido el hombre, los núcleos supraquiasmáticos del hipotálamo (NSQ) constituyen el reloj endógeno del organismo (Turek, 1985). Su ablación hace que cese la actividad rítmica, mientras que el transplante de NSQ fetales al tercer ventrículo de animales arrítmicos, hace que retornen a la ritmicidad. Las neuronas de los NSQ exhiben un patrón rítmico de descargas de potenciales de acción así como de utilización de glucosa, tanto in vivo como in vitro.
Dentro de los NSQ podemos considerar dos zonas. Una, el área de las aferencias visuales, a la que llegan los axones de las vías que portan la información luminosa (vías retinohipotalámica y genículohipotalámica). Las neuronas de este área contienen péptido intestinal vasoactivo (VIP) como principal neurotransmisor, aunque hay algunas neuronas que contienen gastrina. La segunda área se caracteriza por no recibir aferencias visuales, y está integrada por una gran población de neuronas productoras de vasopresina (AVP), así como algunas pequeñas poblaciones de neuronas productoras de somatostatina, encefalinas, péptido atrial natriurético y angiotensina. Las neuronas de ambas zonas, además de producir péptidos, contienen también GABA.
9.2.6.2 Las vías aferentes
Podemos dividirlas en neurales (visuales y no visuales) y humorales. En la actualidad, se admiten dos grandes vías aferentes visuales a los NSQ, el tracto retino-hipotalámico (TRHT) y el tracto genículo-hipotalámico (TGHT). El TRHT se origina en las células ganglionares de la retina, cuyos axones se proyectan a la zona central de los NSQ. El neurotransmisor del TRHT es un péptido pequeño, el N-acetil-aspartilglutamato. El TRHT parece ser suficiente para, en ausencia de otras aferencias, permitir la sincronización de las neuronas de los NSQ por señales luminosas.
También desde las células ganglionares retinianas se proyectan axones hacia las neuronas de unas subdivisiones de los cuerpos geniculados laterales, las llamadas laminillas intergeniculadas (IGL). Estas láminas contienen una población de neuronas que contienen neuropéptido Y (NPY+), reciben la información retiniana, y proyectan sus axones a los NSQ constituyendo, en conjunto, el TGHT. Se supone que la vía del TGHT estaría involucrada en la retroalimentación de la actividad física sobre el marcapaso circadiano, ya que su ablación suprime los cambios de fase en la descarga neuronal supraquiasmática inducidos por la actividad locomotora.
En cuanto a las aferencias no neurales, el NSQ recibe también aferencias de tipo humoral, entre las cuales la hormona pineal melatonina es la más conocida. Se han descrito receptores para melatonina en los NSQ y la administración programada de esta hormona es capaz de inducir la sincronización de determinados ritmos. Recordemos que la melatonina es conocida como la “hormona de la noche”ya que su secreción se limita al periodo de oscuridad y es inhibida por la luz. Consecuentemente, la melatonina constituye una señal química circulante que “mide” la duración de la noche.
9.2.6.3 Las eferencias
La mayor densidad de eferencias de cada NSQ corresponde a proyecciones al NSQ contralateral. Los axones que emergen de los NSQ forman cuatro grandes grupos. El mayor, termina en la zona subparaventricular del hipotálamo y algunas fibras entran en el núcleo paraventricular. El segundo grupo, proyecta al núcleo dorsomedial y área ventral tuberal. El tercer grupo está constituido por fibras que terminan en la zona periventricular y área retroquiasmática. Finalmente, algunas fibras terminan en el hipotálamo lateral y área preóptica. En conclusión, las eferencias del SCN se dirigen principalmente al hipotálamo, especialmente a las áreas adyacentes a los propios NSQ.
La Figura 2, resume los datos más importantes sobre la estructura y conexiones del sistema circadiano humano. Ver la descripción en el pie de figura.
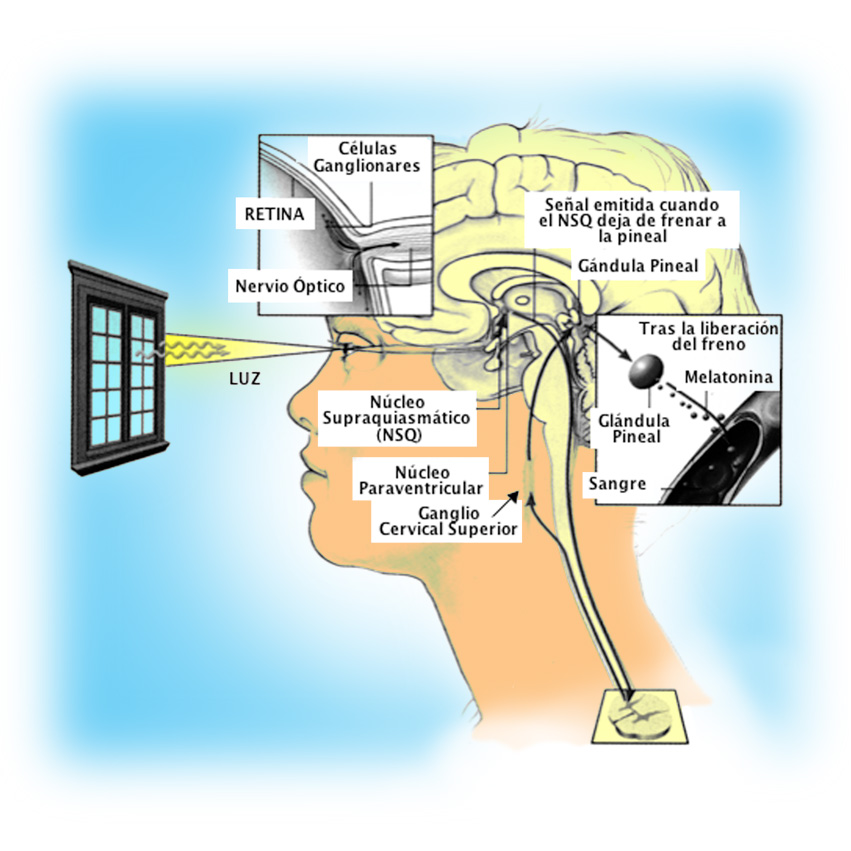
Figura 2. Representación esquemática del sistema circadiano humano y sus principales conexiones. El reloj circadiano es el NSQ del hipotálamo. Su sincronización depende de la llegada de señales luminosas generadas en las células ganglionares retinianas, cuyos axones forman parte del nervio óptico. Una de las eferencias del NSQ es la que, a través del ganglio cervical superior, llega a la glándula pineal, para controlar la secreción de melatonina. En presencia de luz, el NSQ “frena” a la glándula pineal, y no se sintetiza melatonina. La ausencia de luz libera a la pineal del freno ejercido por el NSQ, lo que permite la síntesis y liberación de esta hormona. Modificado de Wright 2004.
9.3 Significación funcional del sistema circadiano
La existencia de un sistema de control capaz de adaptar de manera automática y anticipada las funciones fisiológicas a las necesidades de cada momento del día es, indudablemente, un sistema que facilita el trabajo de los sistemas homeostásicos del organismo. No hace falta recordar el concepto de homeostasis y la existencia de lo que llamamos sistemas de “homeostasis reactiva” que se ponen en marcha cuando una variable se desvía de su rango normal de fluctuación. El sistema circadiano es un regulador “predictivo” de la homeostasis, que ajusta las variables fisiológicas a los valores previsibles para satisfacer las necesidades de cada momento del día, “economizando” la función del sistema homeostásico reactivo.
9.4 Envejecimiento y sistema circadiano. Planteamiento del problema
Podemos intuir el papel de las alteraciones del sistema circadiano en el envejecimiento con un razonamiento puramente “cronobiológico”. El envejecimiento puede entenderse como una pérdida progresiva de la estructura temporal del organismo, caracterizada fundamentalmente por la disminución en la capacidad de adaptación de los ritmos biológicos a las demandas cambiantes que impone el medio externo. Cualquier organismo vivo es un sistema oscilatorio cuyo funcionamiento es tanto mejor cuanto mayor grado de resonancia (sincronización) presente con las oscilaciones del medio externo. El mantenimiento de las condiciones del medio interno, dentro de un rango controlado de variabilidad, depende de la existencia de sistemas de control que llevan a cabo los ajustes adecuados ante cada perturbación que modifique la variable a controlar. El sistema circadiano puede entenderse, tal como decíamos anteriormente, como un elemento que “potencia” o “facilita” la actividad de los sistemas de control homeostásico reactivo al aproximar, en cada momento, los valores de cada variable fisiológica a las demandas en ese momento preciso. De esta manera, las desviaciones que puedan producirse en esa variable y tengan que ser corregidas por el sistema de control homeostásico, serán mínimas.
Veamos un ejemplo que nos ayudará a entender el significado del sistema circadiano. El organismo controla la concentración sanguínea de potasio regulando fundamentalmente su excreción renal. Si el nivel de excreción renal de potasio fuese constante, después de las comidas, como consecuencia de la ingesta de potasio, se produciría un aumento de sus niveles plasmáticos, lo que pondría en marcha los sistemas de homeostasis reactiva, dando lugar, con un pequeño retardo, a un aumento de la excreción renal del ión, para restaurar los valores normales. Sin embargo, si existiera un ritmo circadiano en la excreción renal de potasio, en el que la excreción máxima coincidiera con las horas habituales de la comida, las desviaciones a corregir por los sistemas de control homeostásicos serían mucho menores. Esto último es lo que ocurre en la realidad. Sobre esta idea podríamos considerar pues que las alteraciones del sistema circadiano, reduciendo la capacidad de adaptación al medio, constituyen un elemento importante en el proceso del envejecimiento. Con una reducción de la capacidad para anticiparse a las demandas originadas por los cambios medioambientales, se está más expuesto a la influencia de los mismos.
Numerosos estudios experimentales han demostrado la importancia que para el correcto funcionamiento de los seres vivos tiene la sincronización entre los ritmos internos y los externos. En un experimento considerado ya como clásico, Pittendrigh y Minis (1972) demostraron que, cuando moscas Drosophila nacidas bajo un fotoperiodo LO: 12/12 (12 horas de luz y 12 de oscuridad) eran trasladadas el primer día de su vida adulta a ambientes con fotoperiodos diferentes del de 24 horas (LO: 10,5/10,5 o LO: 13,5/13,5), la duración de su vida disminuía significativamente. En la misma línea, la ablación de los NSQ en ardillas, reduce significativamente su supervivencia cuando son reintegradas a su hábitat natural (De Coursey y cols., 1997). Los hámsteres portadores de la mutación tau (el periodo de su marcapasos endógeno es menor de 24 horas), ubicados en un fotoperiodo normal 12/12h LO, presentan trastornos circadianos caracterizados por un avance en el inicio de la actividad nocturna y una disrupción de su ritmo de actividad locomotora; todo ello junto a una marcada reducción de su longevidad. Sin embargo, si se les trasplantan los NSQ fetales de animales normales, recobran los patrones juveniles de ritmicidad y su expectativa de vida aumenta en un 20% (Hurd y Ralph 1998). Pero es un experimento reciente, llevado a cabo sobre primates (lemures) el que nos induce a una reflexión interesante sobre el papel que el sistema circadiano tiene en nuestra expectativa de vida (Perret, 1997). Estos prosimios, en cautividad, fueron expuestos a ritmos estacionales diferentes a los naturales. En el laboratorio, podemos simular las estaciones del año imitando los cambios fotoperiódicos que acontecen en la naturaleza: días “largos” y noches “cortas” durante la primavera-verano, días “cortos” y noches “largas” durante otoño-invierno. Podemos hacer que un ciclo estacional transcurra en un periodo de 12 meses (como ocurre naturalmente), o hacer que los mismos cambios acontezcan en un periodo de sólo 8 meses, es decir, exponer a los animales a años de 12 u 8 meses respectivamente. La vida media así como la supervivencia máxima de los animales expuestos a años “cortos” se redujo significativamente con respecto a los controles; sin embargo, y esto es lo mas llamativo, si en vez de medir el tiempo de vida media o la expectativa máxima de vida en término de meses lo hacemos en término de ciclos estacionales, en ambos casos los resultados son semejantes: vida media 5 ciclos estacionales y máxima expectativa de vida 9-10 ciclos. Estos resultados parecen indicar que vivimos más que un número de años, un determinado número de ciclos estacionales, y que la aceleración de la alternancia de estos ciclos estacionales, acelera igualmente el proceso de envejecimiento. Es evidente que el experimento mas interesante, y que no se hizo o publicó, sería estudiar si la ralentización de los ciclos estacionales (años “largos”) prolonga la vida media de los animales.
El estudio del papel del sistema circadiano en el envejecimiento presenta dificultades técnicas tanto para el diseño experimental como para la interpretación de los datos. Los diseños experimentales pueden ser básicamente de dos tipos: “longitudinales” y “transversales”. En los primeros, se estudia a cada sujeto a lo largo del tiempo; en los segundos, se comparan grupos de individuos de distintas edades. Es evidente que en la especie humana, con una expectativa de vida relativamente larga, la realización de estudios “longitudinales” plantea graves dificultades, por lo que estos quedan prácticamente restringidos a especies con una duración de vida más corta (moscas, ratas, etc.). Pero, aún con diseños experimentales de tipo “transversal”, el estudio de la especie humana plantea dificultades añadidas cuando se implica al sistema circadiano, ya que es difícil controlar que todos los sujetos objeto de estudio estén bajo condiciones medioambientales idénticas, realicen actividades similares, no tengan diferencias importantes en su grado de deterioro físico, etc. Con carácter general, es también difícil la interpretación de los resultados dado el número de variables convergentes. Veamos un ejemplo. Si comparamos el ritmo circadiano de las variaciones en la concentración plasmática de una hormona entre sujetos jóvenes y viejos, ante la objetivación de diferencias, antes de concluir que tales diferencias reflejan cambios en el sistema circadiano, tendríamos que evaluar hasta qué punto dependen de cambios en la función renal, en la síntesis de proteínas transportadoras, o de procesos patológicos específicos (Touitou y Haus, 1994).
Aunque parezca banal, uno de los primeros inconvenientes que nos encontramos a la hora de analizar la literatura relativa al envejecimiento es delimitar lo que se entiende por individuo “viejo”. En 1979, Comfort definió como “viejos” a los sujetos con edades superiores a la correspondiente a la del 50% de mortalidad para esa especie. Este criterio es el que suele utilizarse en los diseños experimentales con animales de laboratorio, aunque no en el caso de los humanos. También convienen utilizar adecuadamente términos como “envejecimiento” y “senectud”. El primero define el proceso de deterioro progresivo de las funciones fisiológicas que acontece con el paso de los años; el segundo, senectud o senilidad, se refiere a la fase final del proceso de envejecimiento, el que desemboca ya en la muerte. El diccionario de la RAE aplica el término senectud al periodo de vida a partir de los 60 años.
9.5 Envejecimiento y ritmos biológicos
Numerosos estudios en modelos animales, y también en humanos, han demostrado cambios dependientes de la edad que afectan a distintas características de los ritmos circadianos tales como:
- A) El perfil de las variaciones diarias en los fenómenos rítmicos.
- B) El periodo endógeno (tau) de los ritmos.
- C) La sincronización entre distintos ritmos internos.
- D) la capacidad de ser sincronizados por señales externas fóticas y no fóticas.
Con la edad, los ritmos circadianos tienden a ser menos robustos y experimentar cambios tanto de la amplitud como en la fase (generalmente avances). La Figura 3 muestra el perfil medio del ritmo circadiano de temperatura corporal en un grupo de sujetos jóvenes y en otro de viejos. Pueden observarse los dos hechos anteriormente mencionados, por una parte, la menor amplitud del ritmo en los sujetos viejos, y por otra, el avance de fase en estos últimos. Esta disminución en la amplitud de los ritmos, lo que refleja es una pérdida general de la estabilidad y el nivel de las funciones rítmicas (Turek et al., 1995). En roedores y en humanos, la edad disminuye también la amplitud del ritmo de actividad (Minors y Waterhouse 1998), de otros ritmos conductuales como ingesta, bebida, etc (Renfrew y et al., 1987), de las variaciones en los niveles de péptidos y neurotransmisores, y de la densidad de receptores (Simkins y Millard, 1987).
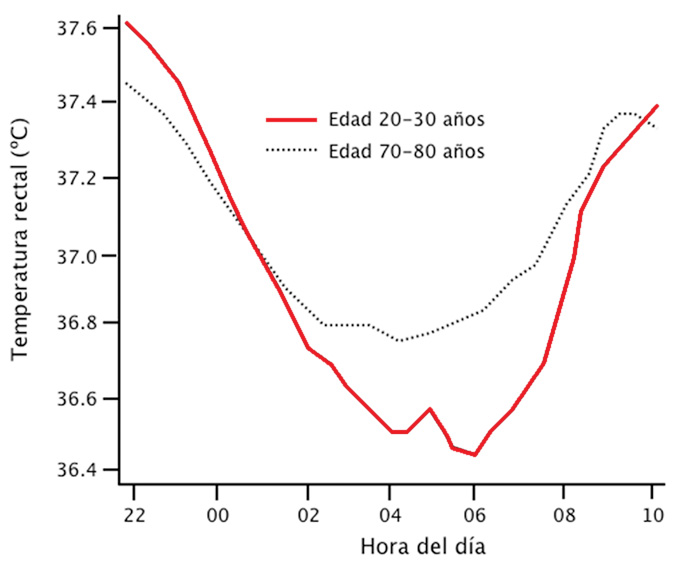
Figura 3. Ritmo diario de temperatura corporal en sujetos jóvenes y viejos. Modificado de Vitiello y cols. 1986.
Quizás los más estudiados hayan sido los cambios que con el envejecimiento afectan al sistema endocrino y se traducen en una disminución de la amplitud de los patrones secretorios de hormonas como GH, LH, testosterona, prolactina, aldosterona, cortisol, epinefrina, norepinefrina y melatonina. Especial importancia tiene la disminución en la amplitud del ritmo de secreción de melatonina (Figura 4), tal como comentaremos mas adelante, dado el papel que esta hormona juega como señal química que regula numerosos ritmos circadianos.
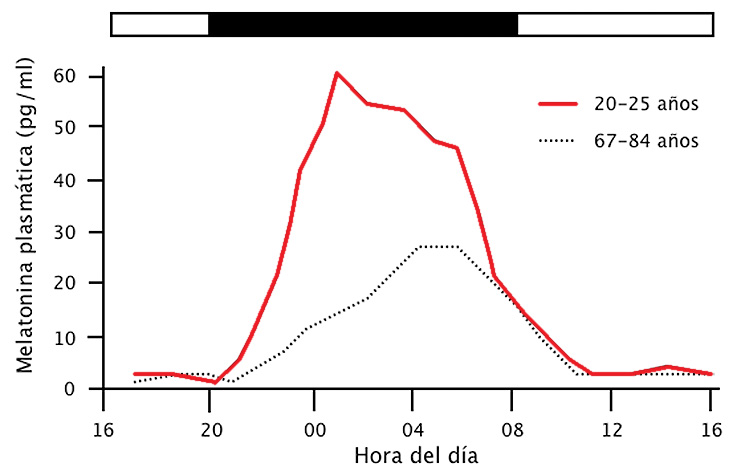
Figura 4. Perfil del ritmo diario de concentración de melatonina plasmática en sujetos jóvenes y viejos. Modificado de Copinschi y cols. 1995.
Otra característica del sistema circadiano de los viejos es el aumento en el tiempo necesario para readaptarse a un cambio de fase. Esto se observa fácilmente por el efecto que los vuelos transmeridianos tienen en sujetos jóvenes y viejos. Es bien sabido que tras un vuelo en el que se atraviesen más de 6 husos horarios, especialmente si es hacia el este, se produce un desajuste entre los ritmos endógenos y las señales sincronizadoras medioambientales (luz), que se manifiesta en un síndrome conocido como jet-lag. Se requiere un tiempo para que el sistema circadiano del sujeto trasladado a otro entorno, se adapte de nuevo al ritmo luz/oscuridad del lugar de destino y este tiempo aumenta significativamente a medida que el sujeto envejece. Por la misma razón, los sujetos de mayor edad se adaptan peor que los jóvenes a los trabajos en turnos rotatorios. Hay, sin embargo, algunas excepciones a esta norma de un alargamiento del tiempo necesario para la resincronización tras un cambio de fase en los animales viejos. Así, en ratones que muestran un fenotipo de envejecimiento acelerado (SAMP8), tras una exposición a un avance de 6 horas en el ritmo luz/oscuridad (equivalente a un vuelo transmeridiano de 6 horas hacia el este) la adaptación es prácticamente inmediata, mientras que en los controles requiere al menos 4 días (Sánchez-Barceló y et al., 1997).
La descripción de los cambios en los ritmos circadianos en relación a la edad plantea una primera cuestión: ¿estos cambios reflejan una alteración del reloj o marcapasos endógeno, o de los efectores periféricos controlados por el reloj?
La respuesta puede ser doble. Es evidente que el proceso del envejecimiento afecta a todo el organismo y la reducción, por ejemplo, de la amplitud del ritmo de secreción de hormonas hipofisarias podría explicarse simplemente por el deterioro de las células secretoras pituitarias, sin recurrir a explicaciones centradas en el deterioro del sistema circadiano que controla tales ritmos secretorios. Sin embargo, cuando además de cambios en la amplitud se observan cambios de fase en el ritmo de secreción, hay que pensar también en la participación de las estructuras que controlan el ritmo de secreción, es decir en los NSQ.
Estudios morfológicos y electrofisiológicos han descritos cambios en los NSQ humanos dependientes de la edad. Recordemos que el periodo de los ritmos circadianos en ausencia de factores de sincronización (situación de ritmo libre o free running) es el correspondiente al reloj endógeno que controla el ritmo (tau). Consecuentemente, los cambios en tau durante el envejecimiento sugieren cambios en la organización interna del reloj biológico (Mailloux et al., 1999). El cambio mas común es un acortamiento de tau, aunque existen discrepancias al respecto. En los NSQ de animales de experimentación (roedores) se han descrito cambios metabólicos (utilización de glucosa) y una disminución de la densidad de receptores alfaadrenérgicos con el envejecimiento. También, en ratas de 32-33 meses (su vida media es de 24-30 meses) se observa una disminución significativa en el número de células secretoras de AVP y VIP en los NSQ (Swaab et al., 1985, Duncan y cols., 2001). Hay suficientes diferencias entre los NSQ de animales jóvenes y viejos, como para sugerir que los cambios observables en los ritmos circadianos tienen su origen en las modificaciones experimentadas por el marcapasos endógeno.
Vamos ahora a analizar la influencia de las modificaciones que con la edad se experimentan en la capacidad de sincronización de nuestro sistema circadiano. Recordemos que los ritmos circadianos son sincronizados a un periodo de 24 horas por señales externas, siendo la más importante el ciclo luz oscuridad, aunque no se excluye la participación de sincronizadores no fóticos, especialmente importantes en ausencia de los primeros. Una forma de medir la capacidad de sincronización de un determinado ritmo biológico es exponer a los sujetos a cambios en el fotoperiodo, evaluando el tiempo que tarda en resincronizarse a la nueva situación. Este tipo de análisis ha revelado que con la edad se pierde la plasticidad del sistema circadiano para responder a agentes sincronizadores. Las razones para este cambio podrían ser varias: el deterioro del marcapasos endógeno, ya comentadas en el párrafo anterior; alteraciones en la vía de transmisión de las señales sincronizadoras hacia los NSQ o en los receptores retinianos.
La edad es un factor determinante de la pérdida de la capacidad de adaptación al trabajo nocturno o en turnos rotatorios. Estos trabajadores, a partir de la cuarta década de la vida suelen padecer trastornos crónicos de salud que se manifiestan como un aumento de la fatiga, problemas de sueño, disminución de la eficiencia del trabajo y un aumento de la siniestralidad laboral. También disminuye significativamente su capacidad de recuperación tras un periodo de trabajo nocturno. El estudio de los ritmos de temperatura de los sujetos de edad avanzada muestra una dramática disminución de la amplitud (Monk et al., 2000). Este es un problema sociolaboral importante, ya que el número de personas de edad avanzada que ejercen trabajos a turnos va en aumento en los países desarrollados.
Una de las hipótesis más estudiada es la que trata de explicar la pérdida de la capacidad adaptativa del sistema circadiano del anciano por el deterioro visual dependiente de la edad. Si la luz es el principal agente sincronizador de los NSQ, la pérdida de agudeza visual significaría una reducción de las señales fóticas que llegan al reloj endógeno. Sin embargo, la mayoría de los datos experimentales contradicen esta idea. La explicación es actualmente bastante clara. Las señales luminosas que llegan a los NSQ para sincronizar su actividad y las que llegan a la corteza visual para mediar la visión de los objetos, tienen distinto origen. Los conos y bastones retinianos son el origen de las señales propias de la sensibilidad visual, pero no de la señales que llegan al sistema circadiano. Es decir, tenemos dos sistemas visuales independientes, el de “ver” y el de “sincronizar ritmos”. Este último utiliza como fotorreceptores las propias células gangliares retinianas, que poseen un fotopigmento, la melanopsina, distinto a las opsinas de conos y bastones; tiene menor capacidad de discriminación y lo que mide es luminosidad. En consecuencia, puede haber sujetos ciegos en cuanto a la función visual, pero cuyo sistema circadiano responda normalmente a la luz. Con la edad, parece producirse un menor deterioro del sistema visual circadiano que del de la visión de objetos.
Sea cual sea la causa de la pérdida de sensibilidad del sistema circadiano a la sincronización por señales externas, lo que si está claro es que esta situación da lugar a una desincronización entre los ritmos internos y los medioambientales. Pensemos en lo que ocurre con un anciano cuyo ritmo actividad/reposo, por ejemplo, no esté sincronizado con el ritmo día/noche. Teniendo en cuenta que este último tiene un periodo de 24 horas y el de actividad/reposo será de aproximadamente 24,5 (recordar que este es el periodo aproximado del marcapaso endógeno en humanos). Cada día el sujeto querrá acostarse y levantarse un poco mas tarde, y al cabo de unos días esas horas de acostarse y levantarse serán completamente “inapropiadas” socialmente hablando, y serán adaptadas a la fuerza, lo que provocará que el sujeto se duerma durante el día y tenga problemas para conciliar el sueño cuando se va a la cama.
Un segundo problema es el de desincronización interna, debida a que los diferentes ritmos sufren un distinto grado de afectación con la edad, generándose relaciones de fase inadecuadas. La desincronización interna es una de las manifestaciones más características del envejecimiento del sistema circadiano. La Figura 5 muestra un ejemplo de lo que entendemos por desincronización interna (leer pie de figura).
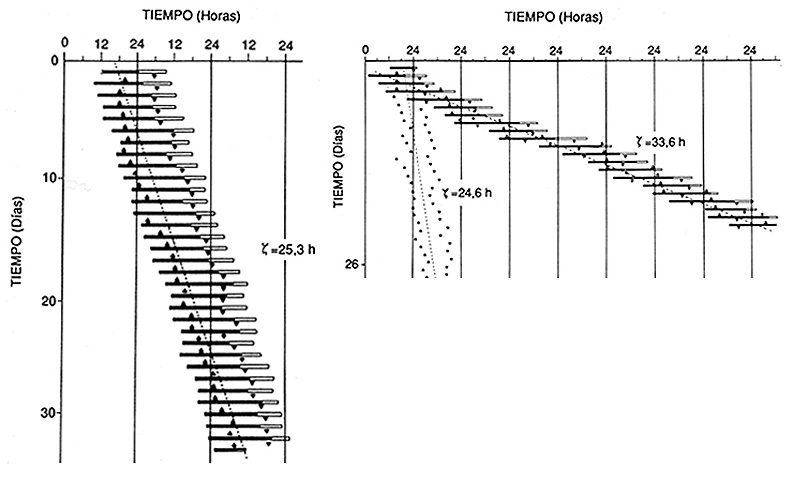
Figura 5. Actogramas reperesentativos de los ritmos circadianos de vigilia/sueño y temperatura corporal en dos sujetos en situación de aislamiento. En ambos casos, el eje de ordenadas representa días consecutivos (leído desde arriba hacia abajo). En abscisas se representan las horas del día. Cada trazado horizontal se compone de una barra que indica el ritmo sueño/vigilia (negro = vigilia; blanco = sueño), y dos marcas triangulares que indican el ritmo de temperatura corporal (vértice hacia arriba = temperatura máxima; vértice hacia abajo = temperatura mínima). En la gráfica de la izquierda se observa que existe una sincronización entre los ritmos circadianos de vigilia/sueño y temperatura corporal, ambos con un periodo (tau) de 25,3 h, correspondiente al periodo propio de su marcapasos endógeno. La gráfica de la derecha representa una situación de desincronización interna; cada uno de los mencionados ritmos muestra un periodo distinto. (Modificado de Weber, 1979).
9.6 Alteraciones del sueño dependientes de la edad
Entre las funciones rítmicas más afectadas con la edad, cabría destacar el ritmo vigilia/sueño, que constituye el paradigma de los trastornos de fenómenos rítmicos asociados al envejecimiento. Si hay una patología común a la mayoría de los sujetos de edad avanzada, esta es la que afecta al sueño. Suele decirse que la edad es, probablemente, el principal elemento determinante de las características del sueño en los humanos, mas que otros factores como el género, o las enfermedades psíquicas o psicosomáticas que puedan afectarles. Es importante reseñar la importancia de este hecho, ya que existe una clara asociación entre trastornos del sueño y enfermedad y/o muerte, siendo la mortalidad entre las personas mayores con trastornos del sueño 1,6 a 2 veces más alta que entre sujetos de la misma edad sin trastornos del sueño (Asplund 1999). Con carácter general, los humanos, a medida que envejecemos, vamos perdiendo “cantidad” y “calidad” de sueño.
El estudio de la patología del sueño mediante polisomnografía es complicado por requerir instalaciones y equipamiento complejo, además de tiempo. Como alternativa para estudios masivos, suelen emplearse herramientas como los cuestionarios de trastornos subjetivos del sueño. El más utilizado es el PSQI (Pittsburg Sleep Quality Index) (Buysse et al., 1989) que mediante una serie de preguntas y una valoración de las respuestas a las mismas, permite una cuantificación de cómo el sujeto percibe la calidad de su sueño. En la Figura 6, correspondiente a los resultados de un estudio reciente sobre más de 700 sujetos sanos, con edades comprendidas entre 10 y 90 años, utilizando el PSQI como herramienta (Gordo y cols., 2001), puede observarse que la calidad subjetiva del sueño disminuye con la edad. Estudios en los que se han correlacionado los resultados del PSQI con análisis objetivos (polisomnografías), han revelado que un valor de PSQI = 5 puede ser considerado como el umbral para definir la existencia de trastornos del sueño. Si nos fijamos en la Figura 6 veremos como, a partir de la década de los 40 años, los valores medios del PSQI superan éste umbral y la prevalencia de trastornos del sueño aumenta significativamente a medida que avanza la edad.
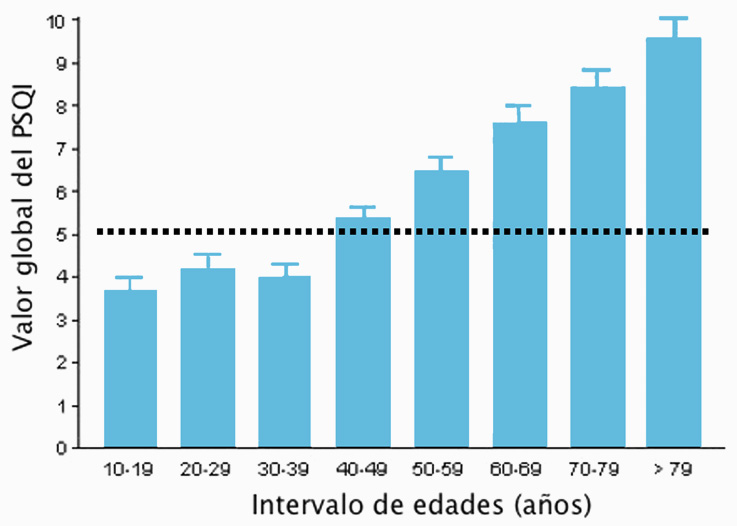
Figura 6. Prevalencia de trastornos del sueño en función de la edad, evaluada mediante el Pittsburg Sleep Quality Index (PSQI). Los valores por encima de 5 se interpretan como representativos de trastornos subjetivos del sueño. El número de sujetos estudiados en cada intervalo de edades oscila entre 15 y 20. Modificado de Gordo et al., 2001.
Con la edad aumenta la latencia del sueño (tiempo transcurrido desde que el sujeto se acuesta hasta que se duerme), así como los periodos de vigilia durante las horas de sueño (interrupciones del sueño), y disminuye la eficiencia del sueño (cociente entre número de horas de sueño y de permanencia en la cama). El número de horas en alerta aumenta con la edad, considerando la suma de los periodos de vigilia nocturna y diurna.
Lo más característico del sueño en los sujetos de edad avanzada es una desestructuración del ritmo vigilia/sueño. El sueño nocturno se interrumpe frecuentemente con periodos de alerta, mientras que la vigilia diurna se interrumpe con siestas y episodios de somnolencia. El anciano pasa un mayor número de horas en la cama y casi siempre refiere somnolencia y fatiga diurnas. Por supuesto, siempre que hablamos de trastornos del sueño en sujetos de edad avanzada es difícil separar los trastornos “puros” del sueño, derivados de alteraciones en las estructuras neurales que controlan el proceso, de aquellos trastornos secundarios a patologías concurrentes, como trastornos renales, cardiopulmonares o digestivos. Un ejemplo es la gran incidencia de trastornos del sueño ligados a problemas cardio-respiratorios como el síndrome de apnea obstructiva del sueño (OSAS), originada por los cambios que con la edad experimentan los músculos de las vías aéreas superiores y los mecanismos de control de la ventilación. En sujetos sanos, pero de edad avanzada, las alteraciones del sueño se suponen debidas a cambios degenerativos en los NSQ dependientes de la edad.
La estructura del sueño en los sujetos de más edad se caracteriza por una marcada reducción del estadio 4. Es importante conocer que la disminución en las horas de sueño que se experimenta con la edad, no afecta de manera simétrica a las distintas fases del sueño, sino fundamentalmente al sueño REM (Figura 7).
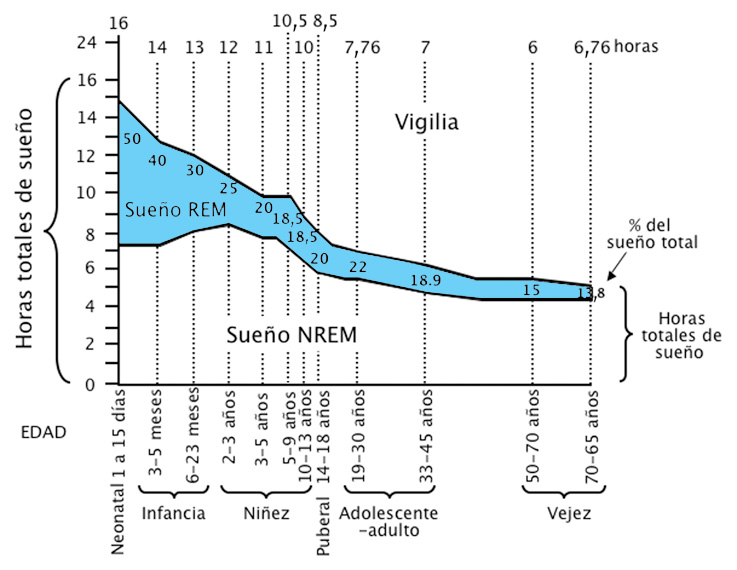
Figura 7. Cambios en los patrones de sueño en función de la edad. Obsérvese cómo las horas de sueño disminuyen con la edad, pero no todas las fases del sueño se reducen en la misma proporción. El sueño REM se reduce mucho más que el NREM. Modificado de Pandi-Perumal et al., 2002.
9.7 Tratamiento de los trastornos del sueño ligados al sistema circadiano
Por su elevada prevalencia, los trastornos del sueño relacionados con la edad suponen un problema social y la búsqueda de respuestas terapéuticas ocupa gran parte de la actividad de los geriatras y médicos de familia. De entre las distintas estrategias terapéuticas para esta patología hay dos basadas en principios cronobiológicos. Una es la luminoterapia. Estudios experimentales demostraron que la exposición de roedores viejos a luz brillante revierte las alteraciones dependientes de la edad en los ritmos vigilia/sueño, así como la reducción del número de neuronas AVP+ en los NSQ. En humanos, han sido descritos beneficios similares en enfermos con síndrome de Alzheimer. En ancianos, la exposición a luz brillante (10.000 lux) durante las primeras horas de la mañana incrementa la eficiencia del sueño nocturno, mejora el estado de alerta diurno y, además, corrige el retardo de fase en el ritmo de temperatura corporal y mejora la capacidad cognitiva y la capacidad física. El otro tratamiento basado en principios cronobiológicos es la administración de melatonina. Recordemos que se trata de una hormona de naturaleza indolamínica secretada por la glándula pineal durante el periodo de oscuridad del ciclo diario. La secreción de melatonina disminuye mucho con la edad (Figura 4) y esta disminución en los niveles circulantes de la hormona ha sido considerada por algunos autores como una de las causas de los trastornos de los ritmos circadianos (entre ellos el sueño) típicos del envejecimiento. Contrariamente a lo descrito para la luminoterapia, la administración de melatonina debe realizarse hacia el final de la tarde, y los resultados obtenidos con este agente cronobiótico parecen ser excelentes. Se trata de una molécula con una vida media de aproximadamente 30 minutos y para la que no se han descrito efectos secundarios relevantes. Sin embargo, a día de hoy, su uso no está permitido por las autoridades sanitarias españolas.
Referencias
- Asplund R. Sleep disorders in the elderly. Drugs and Aging 1999;14:91-103.
- Buysse D. E., Reynolds C. F., Monk T., Berman S. R., Kupfer D. J. The Pittsburg Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Res. 1989;28:193-213.
- Cardinali D. P., Jordá J. J., Sánchez-Barceló E. J. Introducción a la cronobiología. Fisiología de los ritmos biológicos (Eds). Universidad de Cantabria-Caja Cantabria. Santander 1994;1-158. ISBN 84-8102-52-4.
- Comfort A. The myth of senility. Diagnosing nonspecific major illnes in the elderly. Postgrad. Med. 1979; 65:130-142.
- Copinschi G., Van Cauter, E. Effects of ageing on modulation of hormonal secretion by sleep and circadian rhythmicity. Horm. Res. 1995;43:20-24.
- DeCoursey P. J., Krulas J. R., Mele G., Holley D. C. Circadian performance of suprachiasmatic nuclei (SCN)-lesioned antilope ground squirrels in a desert enclosure. Physiol. Behav. 1997;62:1099-1108.
- Duncan M. J., Herron J. M., Hill S. A. Aging selectively suppresses vasoactive intestinal peptide messenger RNA expression in the suprachiasmatic nucleus of the Syrian hamster. Mol. Brain Res. 2001;87:196-203.
- Gordo M. A., Recio J., Sánchez-Barceló E. J. Decreased sleep quality in patients suffering from retinitis pigmentosa. J. Sleep Res. 2001;10:159-164.
- Haus H., Touitou Y. Principles of clinical chronobiology. En: Biologic Rhythms in Clinical and Laboratory Medicine. Eds. Y. Touitou y E. Haus. Springer-Verlag. Berlin-Heidelberg-New Cork. 1994;6-34.
- Hurd M. W., Ralph M. R. The significance of circadian organization for longevity in the golden hamster. J. Biol. Rhythms 1998;13:430-436.
- Mailloux A., Benstaali C., Bogdan A., Auzeby A., Touitou Y. Body temperature and locomotor activity as marker rhythms of aging of the circadian system in rodents. Exp Gerontol. 1999;34:733-40.
- Monk T. H., Buysse D. J., Carrier J, Kupfter D. J. Inducing jet-lag in older people: directional asymmetry. J. Sleep Res. 2000;9:101-116.
- Minors D., Aykinson G., Bent N., Rabbit P., Waterhouse J. The effects of age upon some aspects of lifestyle and implications for studies on circadian rhythmicity. Age Ageing 1998;27:67-72.
- Renfrew J. W., Pettigrew K. D., Rapport S. L. Motor activity and sleep duration as a function of age in healthy men. Physiol. Behav. 1987;41:627-634.
- Simpkins J. W, Millard W. J. Influence of age on neurotrasmitter function. Endocrinol. Metab. Clin. North Am. 1987;16:893-917.
- Swaab D. E., Fliers E., Partiman T. S. The suprachiasmatic nucleus of the human brain in relation to sex, age and senile dementia. Brain Res. 1985:342:37-44.
- Pandi-Perumal S. R., Seils L. K., Kayumov L., Ralph M. R., Lowe A., Moller H., Swaab D. F. Senescence, sleep, and circadian rhythms. Agein Res. Rev. 2002;1:559-604.
- Perret M. Change in photoperiodic cycle affects life span in a prosimian primate (Microcebus murinus). J. Biol. Rhythms. 1997;12:136-145.
- Pittendrigh C. S., Minis D. H. Circadian systems: longevity as a function of circadian resonance in Drosophila melanogaster. PNAS 1972;69(6):1537-1539.
- Sánchez-Barceló E. J., Megias M., Verduga R., Crespo D. Differences between the circadian system of two strains of senescence accelerated mice (SAM). Physiol. Behav. 1997;62:1225-1229.
- Turek F. W., Penev P., Zhang Y., van Reeth O., Zee P. Effects of age on the circadian system. Neurosci. Biobehav. Rev. 1995;19:53-58.
- Turek F. W. Circadian neural rhythms in mammals. Ann. Rev. Physiol., 1985:47-49.
- Touitou Y., Haus H. Biological Rhythms and Aging. En: Biologic Rhythms in Clinical and Laboratory Medicine. Eds. Y. Touitou y E. Haus. Springer-Verlag. Berlin-Heidelberg-New York. 1994;188-207.
- Vitiello M. V., Smallwood R. G., Avery D. H., Pascualy R. A., Martin D. C., Prinz P. N. Circadian temperatura rhythms in young adult and aged men. Neurobiol. Aging 1986; 7:97-100.
- Weber R. A. The Circadian System of Man. Springer-Verlag. Berlin-Heidelberg-New York. 1979.
- Wright K. Time of our lives. Sci. Am. 2004;14:42-49.