• MC-F-012. Capítulo 12. Envejecimiento del sistema cardio-vascular.
12.1 Introducción: factores de riesgo y edad avanzada
El sistema cardiovascular (CV) o circulatorio, constituido por el corazón y los vasos (arterias, capilares y venas), es uno de los sistemas orgánicos más afectados por procesos patológicos durante el envejecimiento como demuestran múltiples estudios. El “Baltimore Longitudinal Study of Aging” (BLSA) dirigido por Nathan Shock, comenzó en el año 1958 a analizar y evaluar de forma bianual, una gran cantidad de parámetros de la población en seguimiento, entre los que se encuentra el efecto del envejecimiento sobre el sistema CV. El “Framingham Heart Study” ha contribuido también, aunque en menor medida, al avance en el conocimiento del envejecimiento CV.
Desde el punto de vista epidemiológico, el nivel de lípidos, la hipertensión arterial, la diabetes, el hábito sedentario, y por supuesto determinantes genéticos, son considerados factores de riesgo vascular; siendo, sin embargo, la propia edad avanzada la que origina mayor riesgo.
|
HIPÓTESIS SOBRE LA EDAD COMO EL MAYOR FACTOR DE RIESGO VASCULAR |
|
– Edad igual a enfermedad. |
|
– Los factores de riesgo CV cambian en número y severidad con la edad. |
|
– El avance de la edad aumenta el tiempo de exposición al riesgo. |
|
– Cambios asociados con el envejecimiento en el sistema CV se asocian con mecanismos fisiopatológicos de la enfermedad CV. |
Tabla 1.
Son diversas las explicaciones (Tabla 1) que se han dado para asociar el propio avance de la edad como el factor de mayor riesgo CV (Lakatta y Levy, 2003). No obstante se debe tener en cuenta que muchas personas alcanzan edades muy avanzadas sin evidencias de enfermedad. El propio paso del tiempo induce un incremento del riesgo, aunque es posible que sea la interacción tiempo (cambios fisiológicos asociados al envejecimiento) y enfermedad (cambios fisiopatológicos subyacentes no ligados al envejecimiento) la que confiera el riesgo.
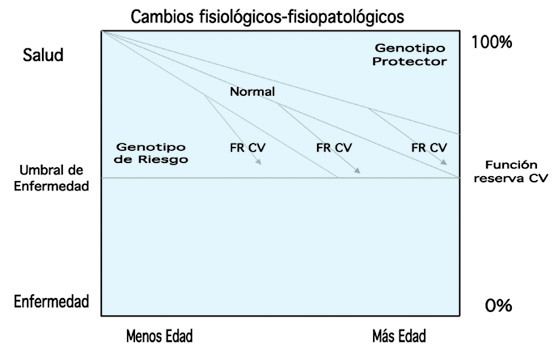
La intersección de las pendientes con la línea del umbral de enfermedad indica la probabilidad de representar enfermedad CV para los diversos genotipos. Las flechas indican cambios de probabilidad al existir factores de riesgo CV.
Figura 1. Se representa gráficamente la conjunción de los conceptos salud, enfermedad, umbral de enfermedad, cambios del sistema CV (tanto fisiológicos como fisiopatológicos), el mejor o peor funcionalismo o reserva CV, los factores de riesgo CV, el genotipo y la propia edad o paso del tiempo.
Es conveniente, por motivos didácticos, dividir el estudio del envejecimiento del sistema CV en dos epígrafes: en primer lugar el corazón y grandes vasos, en los que se puede estudiar el proceso del envejecimiento como si de órganos independientes se tratara. En segundo lugar, el envejecimiento de los capilares, centrado en aspectos relacionados con la biología celular y molecular del sistema endotelial. Este segundo apartado se encuentra más relacionado con el proceso de envejecimiento del órgano en el que asientan los diferentes tipos de capilares: discontinuos (formando sinusoides en el hígado, bazo, y médula ósea) continuos (músculo, pulmón y sistema nervioso central) y fenestrados (tubo digestivo, glándulas endocrinas y glomérulos renales).
12.2 Envejecimiento cardiaco
El corazón puede ser considerado como un conjunto de dos tubos adyacentes plegados y transformados en el músculo cardiaco. Aunque el estudio del envejecimiento cardiaco se podría abordar desde diferentes enfoques parece apropiado estudiar el proceso de envejecimiento del corazón, primero desde un punto de vista anatomoclínico y, en segundo lugar fisiopatológico.
12.2.1 El corazón como músculo: envejecimiento anatomoclínico
Morfológicamente, el corazón es un órgano formado por el endocardio, el miocardio (músculo estriado involuntario), el epicardio, y los sistemas valvular y de conducción de impulsos (Johnson, 1984).
El endocardio se considerara la continuación de la túnica íntima de los grandes vasos que entra y tapiza el interior de las cámaras cardiacas derechas e izquierdas por separado. Al igual que las arterias, está constituido por una capa endotelial que asienta sobre una lámina basal. El miocardio esta formado por miocitos cardiacos unidos entre si por discos intercalares. En las aurículas el miocardio es más fino y presenta más fibras elásticas y de colágeno que en los ventrículos, donde los cardiomiocitos se agrupan en fascículos espirales alrededor de las cavidades ventriculares. El epicardio es la capa externa recubierta por mesotelio sobre el que asienta el pericardio visceral. Junto con las células musculares, el corazón posee también un esqueleto fibroso, formado por tejido conectivo sobre el que se insertan las fibras miocárdicas y el sistema valvular. Este esqueleto fibroso se puede considerar una extensión del tejido conectivo subendotelial.
Los estudios experimentales en animales nos han permitido conocer los mecanismos celulares y moleculares implicados en el envejecimiento cardiaco humano. Durante el proceso de envejecimiento en animales (roedores y primates) aumenta la masa del ventrículo izquierdo surgiendo la hipertrofia ventricular izquierda (HVI). Este crecimiento se debe fundamentalmente al aumento del tamaño de los miocitos, así como a alteraciones en las células conectivas cardiacas que inducen la proliferación de la matriz extracelular en la que los miocitos asientan. Sin embargo, diversos estudios cuantitativos han demostrado que los miocitos, a pesar de estar hipertrofiados, no sólo no aumentan en número sino que disminuyen. La disminución del número de miocitos se debe a procesos de muerte celular tanto por necrosis como por apoptosis, predominando ésta última. La hipertrofia celular se debe a la pérdida de cardiomiocitos que origina un estiramiento de los restantes, y a la sobrecarga cardiaca originada por la rigidez progresiva de las paredes arteriales. Este proceso de alargamiento tanto de los miocitos como de las células conectivas cardiacas adyacentes, origina cambios en los mecanismos de transmisión de señales a nivel celular: mayor presencia de moléculas que modulan el crecimiento celular y la producción de la matriz extracelular, como son la angiotensina II y el factor transformador de crecimiento beta (TGF-b). También se incrementan durante la senescencia cardiaca animal otras moléculas cuya producción en exceso se relaciona con respuestas a estados de estrés crónico.
Con el transcurrir de los años, el corazón humano incluso en sujetos aparentemente libres de hipertensión u otras causas de sobrecarga cardiaca, también presenta un aumento ligero de peso, que refleja hasta cierto punto algún grado de hipertrofia. El espesor de la pared cardiaca se incrementa con la edad en ambos sexos como demuestran las mediciones ecocardiográficas. En series necrópsicas se ha encontrado una hipertrofia de los cardiomiocitos, así como una disminución de su número más aparente en los varones que en las mujeres. Los cardiomiocitos presentan otros cambios propios del envejecimiento como son el acúmulo de granulaciones de lipofucsina y la degeneración celular basófila, aunque estas transformaciones también son observadas en otras situaciones no relacionadas con el envejecimiento (Gerstenblith et al., 1977).
12.2.1.1 Posible reversibilidad de los cambios mediante fármacos
Es posible que determinados fármacos puedan controlar o revertir las modificaciones asociadas a la edad. A nivel experimental aparecen diferencias importantes respecto a los hallazgos del envejecimiento cardiaco, entre animales controles y animales tratados con fármacos del grupo de los inhibidores del enzima convertidor de la angiotensina. Aunque el peso absoluto del corazón no difiere entre los grupos, es mayor en los controles cuando el peso es una proporción del peso corporal. A nivel microscópico en el grupo de los controles se observa una mayor cantidad de tejido fibroconectivo, no apareciendo esta esclerosis en el grupo de animales en tratamiento. La ultraestructura muestra una mayor densidad en el número de mitocondrias en el grupo experimental (Inserra et al., 1995). Recientes estudios en humanos con hipertensión [PRESERVE (Prospective Randomized Enalapril Study Evaluating Regression of Ventricular Enlargement), LIVE (LVH: Indapamide Sustained Release Versus Enalapril) y LIFE (Losartan Intervention For Endpoint Reduction in Hypertension)] han demostrado la eficacia de los fármacos antihipertensivos en la reducción del crecimiento ventricular izquierdo, siendo posiblemente más eficaces los fármacos relacionados con la angiotensina (inhibidores del enzima de conversión y antagonistas del receptor). Desde hace años se considera que este tratamiento puede ser una medida más a implementar si tenemos en cuenta los beneficios obtenidos en resultados de salud cuando sólo evaluamos la reducción de la hipertrofia ventricular en hipertensos, aunque hasta el momento se carecen de ensayos clínicos destinados a evaluar los efectos de reducir la hipertrofia ventricular izquierda en ancianos sin hipertensión (Paciaroni y Fraticelli, 1995; Rosei y Muiesan, 2004; Verdecchia y Angeli, 2004).
12.2.2 El corazón como bomba. Envejecimiento fisiopatológico
Desde el punto de vista fisiológico el corazón nos interesa como sistema de bombeo de la sangre hacia los órganos de nuestra economía. A este nivel adquieren importancia las funciones de llenado (diastólica) y vaciado (sistólica) de las cámaras ventriculares, la frecuencia a la que estos acontecimientos ocurren y el resultado final que se corresponde con el gasto cardiaco.
12.2.2.1 Función diastólica
El llenado ventricular precoz disminuye de forma rápida con la edad de forma que a los 80 años la reducción puede alcanzar el 50%. A esta reducción contribuyen la progresiva fibrosis del miocardio y la actividad residual de los miofilamentos mediada por Ca++ de la sístole precedente. El llenado diastólico tardío no se modifica, aumentando incluso. Esto origina que el cociente llenado precoz/llenado tardío durante la diástole disminuya progresivamente con la edad tal como se ha demostrado mediante técnicas ecocardiográficas en el BLSA y en el Framingham Study (Figura 2).
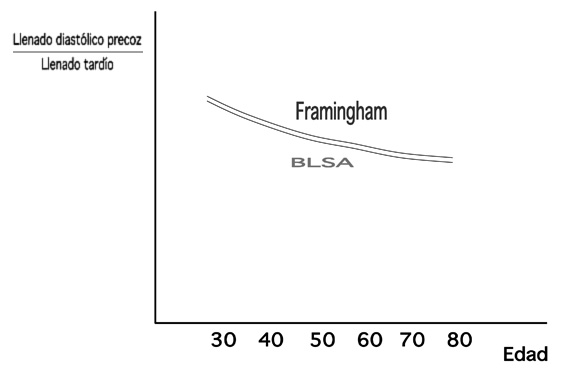
Figura 2. Diagrama que muestra los resultados de los estudios Framingham y BLSA cuando se comparan los valores de llenado diastólico precoz/llenado tardío y su evolución con la edad.
No obstante, en los ancianos sanos el volumen diastólico final relacionado con la superficie corporal no difiere sustancialmente del de sujetos adultos cuando están en reposo, a pesar de los cambios asociados al envejecimiento en el llenado diastólico. Ante el ejercicio máximo en ciclostato, el volumen diastólico final relacionado con la superficie corporal no sólo no disminuye como en los jóvenes, sino que se mantiene. Estos hallazgos no avalan la común creencia de que con el envejecimiento, el llenado diastólico disminuye incluso en los ancianos sanos (Fleg et al., 1995).
12.2.2.2 Función sistólica
Todos los estudios realizados indican que durante el envejecimiento la fracción de eyección del ventrículo izquierdo se mantiene en la mayoría de los ancianos sanos cuando están en reposo. Sin embargo durante el ejercicio, momento en que se alcanza la mayor fracción de eyección, este parámetro decrece progresivamente con el paso del tiempo.
Los cambios mecánicos relacionados con la edad consisten en la prolongación de la duración de la contracción, disminución de las respuestas inotrópicas a las catecolaminas e incremento de la refractariedad. Otros posibles cambios atribuidos al envejecimiento son alteraciones en la relajación, que pueden estar o no relacionadas con la prolongación de la contracción, y variaciones en las propiedades elásticas del propio músculo cardiaco. Cuando se analiza el acoplamiento excitación-contracción en el envejecimiento encontramos que los cambios en la duración del potencial de acción y en la función del retículo sarcoplasmático son los aspectos fundamentales de estas transformaciones cardiacas asociadas al envejecimiento.
12.2.2.3 El corazón como órgano electrofisiológico: envejecimiento del sistema de conducción de impulsos
El sistema de conducción de impulsos constituido por fibras musculares cardiacas modificadas, está separado habitualmente el resto de cardiomiocitos por tejido conectivo. Forman parte de ese sistema el nodo sino-auricular, el nodo aurículo-ventricular y el sistema His-Purkinje. Desde el punto de vista microscópico estas células presentan una menor cantidad de miofibrillas y un mayor contenido de glucógeno.
Tanto el nodo sino-auricular como el aurículo-ventricular disminuyen de tamaño con la edad debido a una pérdida de celularidad. Estas estructuras se infiltran por colágeno, tejido elástico y fibras reticulares, e incluso ocasionalmente se observa infiltración grasa (adipocitos). Al igual que en los cardiomiocitos se pueden encontrar acúmulos de lipofucsina, degeneración basófila celular y depósitos amiloideos, siendo poco probable, sin embargo, que originen anomalías funcionales. En el haz de His y las ramas de Purkinje se pueden observar cambios similares, aunque de menor cuantía.
También se transforman con la edad las características electrofisiológicas del sistema de conducción de impulsos y los cardiomiocitos auriculares y ventriculares. Disminuye la frecuencia de excitación del nodo sino-auricular, y las frecuencias de escape de otras células excitables cardiacas. Los cambios electrofisiológicos de la membrana se han atribuido a modificaciones en las corrientes lentas de entrada de calcio, así como a alteraciones en la conductancia al potasio y otras corrientes iónicas. Los cambios en la fisiología del retículo sarcoplasmático comentados anteriormente también contribuyen a estas alteraciones electrofisiológicas. La sensibilidad y los cambios inducidos por fármacos con acciones cardiovasculares también se ven afectadas por la edad.
12.3 Envejecimiento vascular
12.3.1 El sistema arterial
Podemos clasificar las arterias para su estudio en tres grandes grupos: elásticas, musculares y arteriolas. Las arterias elásticas (aorta, pulmonares y carótidas) están formadas por una amplia túnica media compuesta por fibras elásticas y musculares, rodeadas por una elástica interna hacia el endotelio y una elástica externa hacia la adventicia, de la que se originan los vasa vasorum. Las arterias musculares incluyen la mayor parte del sistema arterial que distribuye la sangre hacia los tejidos, en las que la túnica media está formada por fibras musculares siendo poco frecuentes las elásticas, aunque algunas arterias especiales pueden poseer elástica interna. La contracción o relajación de las fibras musculares regula el flujo sanguíneo y la presión arterial. Por último, las arteriolas están formadas por un endotelio prominente y una media reducida a dos-cuatro capas de células musculares.
12.3.1.1 Envejecimiento arterial en humanos
Durante el proceso del envejecimiento, los cambios más importantes en las arterias elásticas que han sido encontrados en diversos estudios longitudinales en la especie humana son un engrosamiento de la pared arterial, dilatación, elongación y aumento de la tortuosidad y del calibre de la luz. En los estudios necrópsicos, incluso en individuos adultos sanos y sin aterosclerosis, aparece un engrosamiento de la íntima. Los mismos datos se confirman mediante pruebas no invasivas de individuos entre 20 y 90 años sin enfermedad CV, sin que hasta el momento se hayan aclarado suficientemente los factores que contribuyen al engrosamiento arterial. Este engrosamiento de las túnicas íntima y media sería el primer peldaño del proceso aterosclerótico siendo un factor predictor de patología vascular (O´Leary et al., 1999).
Todos estos cambios junto con una disminución de la distensibilidad origina endurecimiento y rigidez arteriales (Lakatta, 1993). Este endurecimiento arterial puede ser evaluado mediante la velocidad de la onda de pulso, que aumenta sistemáticamente con la edad en ambos sexos (Vaitkevicius et al., 1993), relacionándose este aumento con depósitos de calcio, disminución y roturas del contenido de elastina, y aumento del colágeno. Este aumento de la velocidad de la onda de pulso también se asocia, en poblaciones no ateroscleróticas, a la edad, lo que indica que puedan ser procesos independientes. Estudios epidemiológicos recientes concluyen, que estos cambios (incremento del endurecimiento y rigidez arterial) también aparecen en la diabetes y en la aterosclerosis (Dart y Kingwell, 2001; Campuzano et al., 2003).
12.3.1.2 Envejecimiento arterial experimental
El proceso de engrosamiento de las túnicas íntima y media ocurre durante el envejecimiento no sólo en la especie humana sino también en otros primates y en otros mamíferos como los roedores, produciéndose incluso en ausencia de aterosclerosis. El engrosamiento arterial no aterosclerótico se puede correlacionar con el propio proceso de envejecimiento arterial y es comparable a la disfunción endotelial, al incremento de la presión de pulso o a la rigidez arterial (Figura 3).
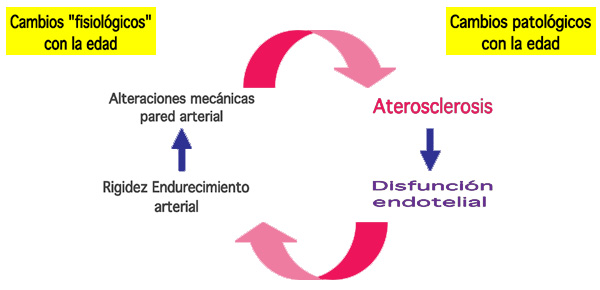
Figura 3. Diagrama que muestra las relaciones entre los cambios fisiológicos y patológicos asociados al envejecimiento arterial.
La administración experimental de dietas hiperlipémicas en animales causa procesos ateroscleróticos más severos en animales viejos que en los jóvenes, por lo que el proceso es posible que no sólo se deba a una presencia excesiva de factores de riesgo clásicos, sino también a un incremento del proceso más acelerado del envejecimiento de la pared arterial (Spagnoli et al., 1991).También concuerdan los datos experimentales con animales en los que se comprueba que el espesor de las túnicas íntima y media se incrementa con la edad, tanto en arterias grandes como en arterias de mediano calibre en los músculos, riñones, cerebro y corazón. Al igual que los cambios cardiacos estos cambios pueden ser parcialmente prevenidos mediante drogas como los inhibidores del enzima convertidor de angiotensina (Inserra et al., 1995). En roedores y primates, el crecimiento de la íntima durante el envejecimiento en ausencia de factores externos, se asemeja a los cambios que ocurren en la íntima cuando se producen lesiones mediante la insuflación de catéteres intrarteriales. Estos cambios presentan una característica adicional llamativa, cual es su mayor extensión y gravedad conforme avanza la edad del animal, y parece que pueden ser debidos a factores intrínsecos de la propia pared arterial. Avala esta hipótesis el que los cambios de la íntima presentan los mismos hallazgos cuando se transplanta la aorta de un animal viejo a uno joven (Jenkins et al., 1998). En el nivel microscópico celular se puede comprobar como tras la lesión experimental se produce una migración y posterior proliferación de las células musculares lisas desde la media a la íntima. Las células circulantes de tipo precursor hematopoyético también pueden migrar desde la luz arterial hasta la región subendotelial, donde se diferencian a células musculares lisas (Figura 4).
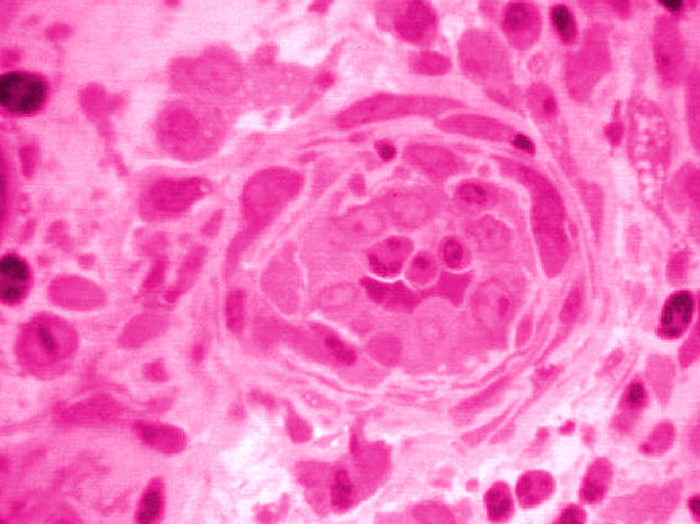
Figura 4. Corte histológico de una arteriola en la que se observa la luz con células sanguíneas, un endotelio engrosado, y proliferación de células musculares lisas formando capas de cebolla.
Este proceso migratorio se ve favorecido por la presencia de metaloproteinasas, secretadas por las propias células musculares lisas vasculares, que inducen aumentos de permeabilidad e incluso pérdida de la lámina basal endotelial (Cheng et al., 1998; Sata et al., 2002). Estas respuestas exageradas del sistema vascular a las lesiones experimentales, durante el proceso de envejecimiento, pueden ser debidas en parte a la propia respuesta exagerada de quimiotaxis y proliferación de las células musculares vasculares en respuesta a factores de crecimiento de origen plaquetario (Pauly et al., 1994).
12.4 Envejecimiento del sistema venoso
En el sistema venoso las túnicas íntima, media y adventicia muestran menos diferencias entre sí a nivel general que en el sistema arterial. En las venas las diferencias estructurales aparecen relacionadas con la localización: por encima o por debajo el corazón; y su situación fija o móvil en el cuerpo. Incluso una misma vena como la cava presenta morfologías diferentes según la localización o el trayecto elegido de la misma. Aún con estas variaciones, todas las venas presentan una pared más delgada que la arteria correspondiente, una menor proporción de tejido muscular y elástico y una íntima más fina. Dentro del sistema vascular, el sistema venoso está diseñado como un reservorio de sangre y es por lo tanto capaz de modificar el volumen sanguíneo que llega al corazón durante los diversos ajustes del sistema CV. Esta capacidad de reserva, supone que pequeños incrementos de volumen en las venas más periféricas (aumento de la capacitancia) van seguidos de cambios sustanciales de volumen a nivel central (volumen de retorno al ventrículo derecho). Se han empleado diversas aproximaciones experimentales basadas fundamentalmente en provocar presiones negativas en regiones inferiores del cuerpo, para modificar cambios en la volemia central y observar como influyen en las respuestas barorreceptoras tanto arteriales como vasculares pulmonares durante el envejecimiento.
En estudios realizados en el sistema femoral y safeno superficial se ha comprobado como el área transversal de las grandes venas se modifica poco con el envejecimiento, siendo el incremento del índice de masa corporal (IMC) más influyente para el aumento del área o dilatación venosa (Kroger et al., 2003). Dado el papel que desempeñan las venas en la capacitancia del sistema vascular, la complianza venosa es otro parámetro habitualmente analizado ya que afecta a las respuestas vasculares del organismo frente a los cambios ortostáticos. La edad y un peor estado de salud influyen negativamente en la complianza venosa haciendo que esta disminuya (Hernández y Franke, 2004). La conclusión es que la disminución de la capacitancia venosa con la edad puede ser la responsable de la atenuación de la respuesta hemodinámica que se observan en ciertas situaciones en los pacientes ancianos, con un menor incremento en la frecuencia cardiaca y la resistencia periférica, una atenuación en la disminución de la presión arterial sistólica, presión de pulso y flujo sanguíneo en las extremidades. El aumento del ratio colágeno/elastina y el aumento del espesor de la pared venosa con la edad, que originan aumentos del endurecimiento de la pared similares a los observados en las arterias, podrían ser una posible explicación en la disminución de la capacitancia. Además en los sujetos con peor estado funcional, las diferencias en las propiedades de capacitancia y compliance venosa se pueden ver todavía más comprometidas.
Todavía no ha sido bien definido el significado fisiopatológico de los cambios en el sistema venoso con la edad, aunque parece claro que tiene unas notables influencias en la homeostasis de la volemia en relación a la disminución de la compliance. Esta disminución de la compliance implica que la respuesta de capacitancia durante estados hipovolémicos agudos sea deficiente. Puesto que estos mecanismos suponen la primera línea en el mantenimiento de la homeostasis de la volemia, las modificaciones relacionadas con la edad podrían impedir sustancialmente la posibilidad de sobrevivir a una pérdida aguda de sangre en los pacientes geriátricos (Olsen y Lanne, 1998).
12.5 Envejecimiento capilar: disfunción endotelial
Los procesos de envejecimiento vascular no ocurren en un contexto aislado sino que están inducidos o provocados, por procesos muchos más complejos relacionados con la disfunción endotelial. Este fenómeno es capaz de regular el estado de contracción-relajación de la musculatura lisa de la pared vascular así como otros aspectos relacionados con la estructura y función vascular. En estadios precoces o iniciales de diabetes, aterosclerosis e hipertensión se identifican alteraciones en la función endotelial, originando todo ello un círculo vicioso que potencia de forma continua las alteraciones existentes (Figura 3). Además en múltiples lechos vasculares tanto de la especie humana como de animales de experimentación, se ha observado un aumento de la permeabilidad endotelial y una reducción de la respuesta vasodilatadora dependiente de óxido nítrico (NO) y mediada por la acetilcolina. La respuesta endotelial a los estímulos agonistas de tipo ß2 es menor por una disminución tanto en el número como en la afinidad de los receptores ß (Taddei et al., 1995; Gimbrone, 1999). Un resumen de los principales cambios que acontecen con el envejecimiento en el sistema CV se muestra en la Tabla 2.
|
CAMBIOS DEL SISTEMA CV DURANTE EL ENVEJECIMIENTO |
|||||||
|
MORFOLOGÍA CARDIACA |
FUNCIÓN CARDIACA |
ARTERIAS Y VENA |
ENDOTELIO |
||||
|
Peso |
↑ |
Fracción eyección |
≈ |
Espesor pared |
↑ |
Permeabilidad |
↑ |
|
Cardiomiocitos volumen |
↑ |
Volumen eyección |
≈ |
Colágeno |
↑ |
Liberación NO |
↓ |
|
Cardiomiocitos número |
↓ |
Gasto cardiaco |
≈ |
Elastina |
↓ |
Mediadores Inflamatorios |
↑ |
|
|
|
Llenado diastólico inicial |
↓ |
Proteoglicanos |
↑ |
Actividad SOD |
↓ |
|
|
|
Llenado diastólico final |
↑ |
CMVL número |
↑ |
Vasodilatación por ß-adrenérgicos |
↓ |
|
|
|
Cronotropismo ß-adrenérgicos |
↓ |
Distensibilidad |
↓ |
|
|
|
|
|
Inotropismo a ß-adrenérgicos |
↓ |
Velocidad de Onda Pulso |
↑ |
|
|
|
|
|
Inotropismo a digital |
↓ |
Resistencias periféricas |
↑ |
|
|
|
|
|
Gasto cardiaco en ejercicio |
↓ |
|
|
|
|
|
|
|
Liberación péptidos natriuréticos ? |
↑ |
|
|
|
|
Tabla 2.
12.5.1 El envejecimiento de los capilares glomerulares
Una de las estructuras vasculares más específicas de nuestra economía se encuentra en el riñón formando parte de la nefrona: el glomérulo. Está compuesto por un ovillo de vasos capilares con una estructura endotelial fenestrada y rodeados de una lámina basal y unas células epiteliales muy diferenciadas: los podocitos con sus pies vasculares (pedicelos). Mezclados entre estos ovillos de capilares se encuentran las células mesangiales, todo ello rodeado por la cápsula de Bowman. La función fundamental del glomérulo es la filtración del plasma para la eliminación de determinadas sustancias presentes en la sangre mediante la formación de orina.
El riñón y sus glomérulos son una de las estructuras biológicas en las que el proceso de envejecimiento es más aparente y fácilmente medible si lo consideramos como pérdida de función. La forma más sencilla de estimar esta pérdida de función es evaluar el aclaramiento de sustancias endógenas, siendo la creatinina la que se utiliza habitualmente. La pérdida de la función renal con la edad está muy bien establecida y en la especie humana es de un 1% anual a partir de los 30 años.
Son múltiples los estudios acerca de los cambios y transformaciones morfológicas de los capilares y del resto de estructuras glomerulares, estando las modificaciones descritas incluso a nivel ultraestructural. Estos cambios asociados con la pérdida de función renal provocada por el envejecimiento se denominan glomeruloesclerosis. En el proceso de glomeruloesclerosis suele aparecer una hipertrofia glomerular junto con una proliferación de las células glomerulares epiteliales y mesangiales. Las membranas basales y el espacio intercelular mesangial suelen estar engrosados, aparecen aumentos de determinados tipos de colágeno de origen mesangial, así como incremento de la matriz extracelular. Las asas capilares pueden presentar dilataciones aneurismáticas comprobándose la existencia de abundante material amorfo PAS-positivo, infiltración por células inflamatorias y restos celulares en las propias asas capilares. Con el paso del tiempo, ocupan el glomérulo grandes cantidades de material amorfo siendo indistinguibles a nivel óptico sus componentes habituales (Figura 5), pudiendo decir que la gloméruloesclerosis es el resultado de la acumulación progresiva de proteínas que conforman la matriz extracelular glomerular.
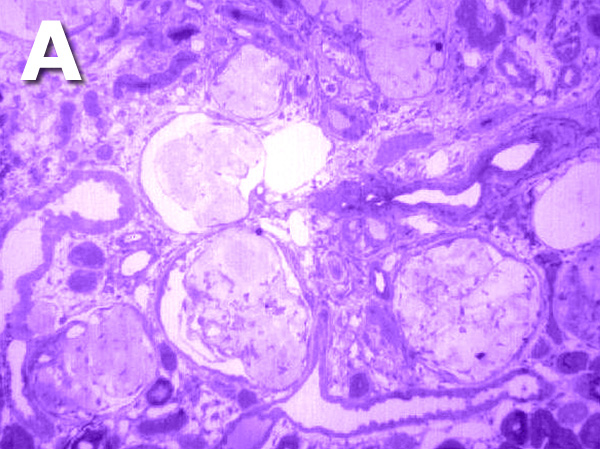
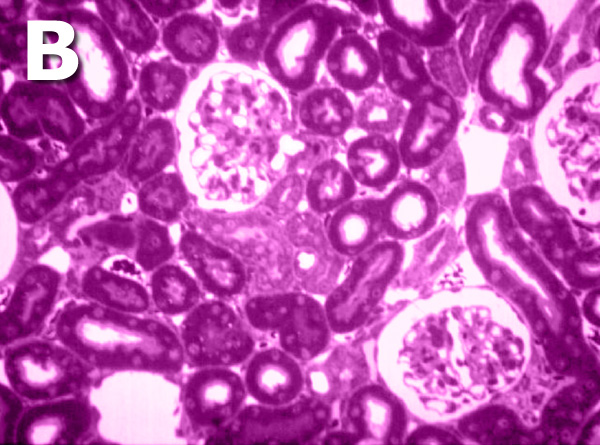
Figura 5. Microfotográfias que muestran un riñón envejecido con un intenso proceso de glomeruloesclerosis (A) y un riñón adulto sano como comparación (B).
Las investigaciones actuales se centran en desentrañar los mecanismos moleculares de esta alteración. Parece que inducen este proceso el sistema renina-angiotensina-aldosterona (SRAA) y el factor transformador de crecimiento b (TGB -b). Factores que, como ya hemos comentado, participan de forma directa en el crecimiento ventricular y en la proliferación de la matriz extracelular, desempeñando por tanto un papel crucial en determinados procesos de envejecimiento vascular. El TGF-b es segregado junto con otras sustancias vaso-activas, citoquinas y factores de crecimiento por las células endoteliales de los capilares glomerulares. Por último señalar como algunos factores relacionados con riesgo CV y envejecimiento, como la hiperhomocisteinemia, también están implicados en el envejecimiento y esclerosis glomerular (Gimbrone, 1999; Zheng et al., 2003).
12.5.2 Envejecimiento capilar en el sistema nervioso central. La barrera hematoencefálica
La barrera hematoencefálica (BHE) es una estructura única en el organismo y se puede definir funcionalmente por regular el intercambio de iones y moléculas orgánicas entre el plasma sanguíneo y el parénquima cerebral. Funciona como modulador del transporte de nutrientes desde el torrente sanguíneo hasta el medio interno cerebral. Mientras que el proceso general de intercambios mediados por la BHE no está muy afectado por el proceso de envejecimiento, si se ha visto una alteración selectiva para transportadores específicos tanto en humanos como en animales de experimentación (colina y glucosa). La BHE está adquiriendo gran importancia por ser al lugar de asiento de diversas patologías neurodegenerativas (Shah y Mooradian, 1997). Paradójicamente, la BHE es la encargada de aislar el sistema nervioso del exterior; esto hace que algunos fármacos excelentes para tratar patologías en otras regiones del organismo no sean eficaces en el sistema nervioso al no atravesar la BHE.
12.6 La aterosclerosis: fenómeno asociado al Envejecimiento CV
La aterosclerosis es considerada actualmente un proceso inflamatorio crónico. Algunas regiones del árbol arterial, como las bifurcaciones, son particularmente propensas al desarrollo de lesiones ateroscleróticas. A estos niveles se producen cambios considerados inicialmente focales como son: a) Deterioro endotelial debido a la pérdida de los mecanismos endógenos ateroprotectores como es la producción de NO, b) Incremento de la permeabilidad vascular a las macromoléculas circulantes como las partículas de las lipoproteínas de baja densidad (LDL) y, c) Aumento del estrés de la pared arterial con activación de los elementos celulares que la componen. Por tanto, la penetración de los leucocitos en la íntima, la acumulación a nivel subendotelial de partículas de LDL oxidadas y la activación y migración de las células musculares lisas desde la media son elementos clave en el desarrollo de la placa aterosclerótica (Figura 6).
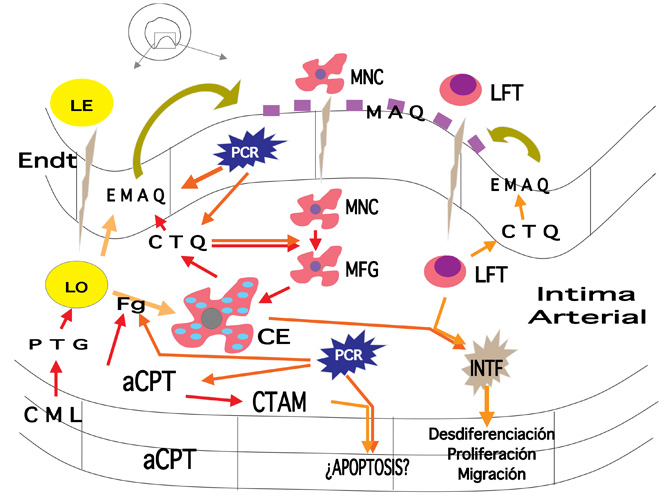
Figura 6. Diagrama que expresa diversos aspectos del proceso de aterogénesis vascular. aCPT: activación de complemento. Endt: endotelio. CE: célula espumosa. CML: células musculares lisas. CTAM: complejo terminal atacante de membrana. CTQ: citoquinas. EMAQ: expresión de moléculas de adhesión y quimiotaxis. Fg: fagocitosis. INTF: interferón. LE: lípidos elevados. LO: lípidos oxidados. LFT: linfocito T. MAQ: moléculas de adhesión y quimiotaxis. MFG: macrófago. MNC: monocito. PCR: proteína C reactiva. PTG: proteoglicanos.
El papel fundamental de la inflamación es evidente tanto en el inicio de las lesiones como en su progresión y complicaciones. Las lesiones iniciales no son más que la expresión de la interacción entre el endotelio inflamado y los leucocitos circulantes. El reclutamiento de los elementos inflamatorios dentro de la íntima es iniciado mediante la expresión en la superficie luminal endotelial de moléculas de adhesión y quimiotaxis (MAQ) [moléculas de adhesión vascular celular 1 (VCAM-1), moléculas de adhesión intercelular 1 (ICAM-1) y selectinas de ligandos leucocitarios]. Las partículas de LDL atrapadas en la matriz subendotelial sufren oxidación, lipólisis y agregación, que originan un aumento de su actividad pro-inflamantoria. Las LDL mínimamente oxidadas actúan a nivel endotelial produciendo más moléculas pro-inflamatorias, mientras que cuando son fagocitadas las LDL altamente oxidadas promueven la formación de células espumosas. Como el proceso inflamatorio continúa se suman linfocitos, macrófagos, que junto con las células espumosas y las células vasculares de la pared segregan citoquinas y factores de crecimiento induciendo una mayor proliferación y migración de las células musculares lisas (Hansson, 2005).
El crecimiento de las células musculares lisas es el elemento clave en el desarrollo de las lesiones ateroscleróticas. Se piensa que los cambios fenotípicos de estas células son un prerrequisito para su proliferación. De hecho las células musculares lisas antes de migrar y proliferar en la íntima, sufren un proceso de desdiferenciación que les conduce a la adquisición de un perfil sintético indiferenciado. Este proceso de desdiferenciación puede ser desencadenado por una gran variedad de estímulos entre los cuales destacan la hipertensión y la hipercolesterolemia (Sartore et al., 1997). La modulación fenotípica probablemente también ocurra en la adventicia, con la activación de los fibroblastos y miofibroblastos como respuesta a las diferentes tipos de lesiones vasculares.
La inflamación no sólo participa en la progresión de la placa aterosclerótica, sino que también juega un papel crucial en la pérdida de su estabilidad. Los eventos vasculares agudos dependen más de la composición y estabilidad de la placa que del grado de estenosis de la misma. Las lesiones vasculares vulnerables poseen un elevado número de elementos inflamatorios activados, con un contenido relativo de células musculares lisas escaso. Los factores que originan las complicaciones trombóticas de la aterosclerosis son la erosión física de la cubierta fibrosa de colágeno de la placa, junto con la exposición al torrente sanguíneo del centro necrótico de la misma. La integridad de la cubierta fibrosa de colágeno de la placa depende del equilibrio dinámico entre la producción de la matriz extracelular por las células musculares lisas y la degradación enzimática de la misma. Parece que en ambas situaciones participan mediadores de inflamación: por un lado el interferón g producido por los linfocitos T activados que es capaz de inhibir la síntesis de colágeno por las células musculares lisas y por otro, los macrófagos activados que son los encargados de la producción de enzimas proteolíticos capaces de degradar esa cubierta fibrosa de la placa.
Debido a la participación del proceso inflamatorio en la aterosclerosis se ha especulado con la posibilidad de un intercambio libre de iones y moléculas orgánicas entre el plasma sanguíneo y el organismo. La presencia de determinados marcadores de inflamación circulantes, así como la de algunos agentes patógenos, les confiere un papel como nuevos factores de riesgo en el desarrollo de la aterosclerosis y de su consecuencia fundamental: la enfermedad vascular. De entre todos estos nuevos factores y marcadores parece que es la proteína C reactiva (PCR) la más relevante.
12.7 La proteína C reactiva (PRC): marcador de aterosclerosis-enfermedad vascular
La PCR es considerada un miembro prototípico de los reactantes de fase aguda en la especie humana. Pertenece a la familia de las pentraxinas, grupo de proteínas muy preservadas durante la evolución y que preceden al desarrollo de las respuestas inmunes. Sus niveles sanguíneos son el resultado directo de su síntesis hepática. La activación del gen encargado de su síntesis está producida por la interleucina-6 (IL-6). La interleucina-1 (IL-1), los glucocorticoides, y los productos de activación del complemento actúan sinérgicamente potenciando las acciones de la IL-6. La función biológica principal de la PCR es el reconocimiento de patógenos y de las células dañadas del huésped (incluidos antígenos nucleares, lipoproteínas y células apoptóticas) y participar en su eliminación activando las células fagocíticas y el sistema de complemento.
En los últimos años numerosos estudios relacionan los niveles elevados de PCR con la posibilidad de desarrollar enfermedades cardiovasculares en el futuro. La cuestión más importante a este respecto es determinar si la PCR es sólo un marcador muy sensible de la inflamación sistémica o si, por el contrario, es un factor que contribuye al desarrollo y progresión de la placa aterosclerótica y a su inestabilidad. La posibilidad más sencilla es considerar la PCR únicamente como un marcador de inflamación; sin embargo estudios recientes indican que se trata de un elemento activo dentro de la génesis de la placa aterosclerótica. Se ha comprobado su presencia en la íntima arterial estando la cantidad de PCR dentro de la lesión aterosclerótica directamente relacionada con la actividad del proceso inflamatorio. En la mayoría de las células espumosas de la placa aterosclerótica localizadas a nivel subendotelial se detecta la presencia de la PCR, complejo destructor de membrana y complemento, así como otras moléculas que indican inflamación y progresión de la placa aterosclerótica. La compleja relación entre promotores, mediadores y activadores de inflamación y placa aterosclerótica se muestra en la Figura 6.
Los fenómenos ateroscleróticos se inician de forma regular en la segunda-tercera década de la vida, aunque no son excepcionales los hallazgos en niños pequeños e incluso en lactantes (Matturri et al., 2004). En el momento actual hay un amplio acuerdo sobre la existencia de nuevos factores implicados en el desarrollo de la aterosclerosis, siendo la inflamación endotelial y el bajo peso al nacer por retraso en el crecimiento intrauterino aspectos determinantes (Libby et al., 2002; Fagerberg et al., 2004). En las fases precoces del proceso aterosclerótico se encuentran con frecuencia células de la serie blanca en la íntima, predominantemente linfocitos T y monocitos que se fijan a las moléculas de adhesión y quimiotaxis [moléculas de adhesión vascular celular (VCAM-1)] presentes en el endotelio vascular y que migran al interior de la íntima. Este proceso inicia y perpetúa la respuesta inflamatoria local. Posteriormente los monocitos se van transformando en macrófagos para finalmente dar origen a células espumosas. Los linfocitos T expresan citoquinas inflamatorias que atraen más macrófagos, estimulan las células endoteliales y favorecen la proliferación de las células musculares de la íntima (Figura 6).
Los lugares que experimentan alteraciones del flujo circulatorio laminar, como las bifurcaciones de las ramas arteriales, parece que son lugares específicos de riesgo aterosclerótico, mostrando también alteraciones en los mecanismos protectores de la aterosclerosis. La producción de NO (factor inhibidor de la agregación plaquetaria, de la proliferación de las células musculares lisas de las arterias y de la expresión de las moléculas de adhesión vascular celular VCAM-1) está disminuida en esas regiones (De Caterina et al., 1995). Además las células musculares lisas de esas bifurcaciones arteriales presentan un incremento en la producción de proteoglicanos que promueven más inflamación mediante la facilitación de la oxidación de las lipoproteínas (Lee et al., 2001).
La ruptura brusca de la placa aterosclerótica, más que la progresiva reducción de la luz vascular es la causante de los eventos vasculares. La ruptura de la placa precipitando el fenómeno trombótico se puede relacionar tanto con causas mecánicas como inmunológicas. La degradación del colágeno de la placa fibrosa por enzimas proteolíticos producidos por los macrófagos, hacen a la placa susceptible de ruptura, produciéndose un factor tisular procoagulante que desencadena la trombosis. Por último dentro de este complejo fenómeno, la presencia de una PCR elevada en sangre, se asocia con un incremento de morbi-mortalidad CV en humanos, independiente de otras variables o factores de riesgo CV. Este marcador de inflamación, inhibe la liberación del NO, promueve la activación del los monocitos y su adhesión al endotelio, incrementa la penetración de las lipoproteínas de baja densidad (LDL) en la placa de ateroma, y es el mediador o activador de numerosos mecanismos celulares perjudiciales a nivel endotelial (Jialal et al., 2004).
12.8 Repercusiones directas del proceso de envejecimiento vascular en la clínica geriátrica: del reflejo barorreceptor a la hipotensión postural del anciano
En los individuos sanos, al cambiar de la posición supina a la erecta se inicia de forma inmediata el almacenamiento ortostático de sangre en el sistema venoso en las piernas y en el abdomen. El volumen de sangre desplazada puede ser de hasta un litro aunque la cantidad de sangre desplazada desde el tórax a las regiones inferiores del cuerpo varía dependiendo del tipo de cambio ortostático. La mayor parte del desplazamiento de la sangre ocurre en los primeros 10 segundos, completándose entre 3 y 5 minutos. Posteriormente puede haber un secuestro lento de sangre dependiendo del grado de relajación de los vasos de capacitancia. De esta sangre, el 80% se almacena en las piernas y dentro de ellas fundamentalmente en muslos y nalgas y en menor medida en piernas y pies. Un pequeño volumen adicional puede situarse en la pelvis y el abdomen. Además de este desplazamiento de sangre a las regiones inferiores del cuerpo durante los cambios ortostáticos bruscos, la volemia central decrece ligeramente debido a un proceso de filtración transcapilar del plasma sanguíneo hacia el compartimiento extracelular intersticial, que puede suponer hasta un 15% de la volemia tras diez minutos de ortostatismo.
Como consecuencia de los cambios y desplazamientos de volúmenes sanguíneos por acción gravitatoria, se reduce el retorno venoso a la aurícula derecha, lo que supone una disminución de hasta un 20% en el volumen diastólico final, en el volumen de eyección ventricular y en el gasto cardiaco. El control de estos cambios de volemias y presiones se realiza mediante actividades de regulación del sistema nervioso autónomo.
El reflejo barorreceptor u ortostático (RBR) es un elemento importante de este sistema al permitir mantener las funciones a los individuos en la posición erecta, siendo el principal mecanismo de regulación y control de la presión arterial a corto plazo (segundos-minutos). Los principales receptores implicados en la regulación del RBR son mecano-receptores localizados en los senos carotídeos, el arco aórtico el corazón y los pulmones. Los receptores de esta última localización parecen desempeñar un papel secundario como se demuestra al comprobar que la denervación cardiopulmonar afecta mínimamente a este RBR, siendo sin embargo muy llamativa la hipotensión secundaria a la denervación carotídea (Tabla 3) (Smit et al., 1999).
|
ASPECTOS QUE IMPLICAN A LOS BARORRECEPTORES CAROTÍDEOS Y AÓRTICOS EN EL CONTROL DE LAS RESPUESTAS AL ORTOSTATISMO |
|
1) Respuesta vigorosa de estos receptores a los cambios rápidos de presión pero no a los lentos. |
|
2) Diferencias de presión detectadas entre receptores aórticos y carotídeos. |
|
3) Alteraciones en el control de los cambios de presión ortostáticos tras la denervación quirúrgica de los senos carotídeos. |
Tabla 3.
Circunstancias que alteran el mecanismo del RBR, como tumores cervicales o alteraciones en el mismo por el proceso de envejecimiento originan cambios fisiológicos de gran importancia clínica, llegando en los casos severos a alterar de manera profunda el mantenimiento de la posición erecta. La afectación del reflejo barorreceptor se detecta fácilmente por los cambios que aparecen en la frecuencia cardiaca y en la presión arterial al pasar de forma brusca de la posición supina al ortostatismo.
El paso de la edad se asocia con incremento en las cifras de presión arterial y reducción de la sensibilidad del RBR. Sin embargo esta reducción de la sensibilidad del reflejo barorreceptor con el paso del tiempo ocurre sólo hasta la cuarta década, afectándose levemente a partir de esa edad. No obstante en los ancianos hipertensos la afectación del RBR parece que es mucho más severa. Aunque tradicionalmente se ha pensado que el aumento de la rigidez vascular impide la adecuada función de los barorreceptores aórticos y carotídeos, bien a través de cambios estructurales (aterosclerosis) o de cambios funcionales (reducción en la actividad del óxido nítrico), se están implicando también trastornos de procesamiento del reflejo a nivel del sistema nervioso central (Ford, 1999).
La relevancia clínica de estos cambios es variable. En ancianos sanos, los cambios en la sensibilidad del RBR no parecen tener consecuencias importantes. La hipotensión postural es poco frecuente en ancianos normales a pesar de los problemas de este reflejo. Sí se afectan, sin embargo, las respuestas de los ancianos a las drogas vasodilatadoras, con reducción de la respuesta taquicárdica refleja y del volumen de eyección, lo que origina caídas más severas de la presión arterial, que condicionan un mayor riesgo de hipotensión ortostática inducida por estos fármacos.
Recientemente se ha asociado la alteración del RBR en los ancianos con la presencia de síncope vasovagal, arritmias cardiacas y aumento de la mortalidad en los ancianos que han sufrido un infarto de miocardio. El uso de los fármacos cardiovasculares en los ancianos se puede optimizar mediante el conocimiento de sus efectos sobre el RBR y de sus posibles acciones adversas como las caídas secundarias a la hipotensión postural y a los síncopes, introduciendo medidas que contrarresten estos efectos secundarios (Tabla 4).
|
FÁRMACOS QUE CONTRIBUYEN A LA APARICIÓN DE HIPOTENSIÓN POSTURAL EN EL ANCIANO |
|
– Anticolinérgicos. – Hipotensores. – Vasodilatadores. – Diuréticos. – Nitratos. – Levodopa y otros antiparkinsonianos. – Inhibidores de la monoamionooxidasa. – Neurolépticos-Antipsicóticos. – Antidepresivos tricíclicos. |
Tabla 4.
La hipotensión postural fue considerada, inicialmente, como una curiosidad clínica. El amplio uso que se dio posteriormente a una serie de fármacos que inducían hipotensión postural, hizo que ésta cobrase mayor importancia. Esta caída brusca de la presión arterial origina sensaciones molestas de vahídos, mareos, borrosidad visual y en última instancia pérdida de conciencia y caídas. No sólo los cambios de posición, sino que otras situaciones como la micción o la defecación pueden contribuir a su aparición. Desde el punto de vista fisiopatológico consiste en una caída en las cifras de presión arterial de 20 o más mm Hg en la sistólica y/o de 10 o más mm Hg en la diastólica, al pasar de la posición supina al ortostatismo. Aunque estos cambios en la presión arterial tienen importancia en cualquier región del organismo, adquieren una relevancia capital a nivel cerebral, ya que este órgano es imprescindible para mantener un adecuado control homeostático del flujo y presión sanguínea. El control del flujo sanguíneo cerebral se produce incluso con amplias oscilaciones en las cifras de presión arterial en individuos normales (60-140 mm Hg) y todavía en rangos más amplios en hipertensos.
Los síntomas de isquemia cerebral (vahído, mareos, visión borrosa, acúfenos, desorientación y eventual pérdida de conciencia) aparecen cuando la presión arterial cerebral cae por debajo del límite de autorregulación, lo que suele ocurrir con cifras inferiores a 40 mm Hg. En algunos ancianos sintomáticos esta mala regulación del flujo sanguíneo cerebral se debe no sólo a problemas del reflejo barorreceptor periférico, sino también a trastornos en la propia regulación central adrenérgica y colinérgica que contribuyen a agravar la situación. Además de los controles reflejos también se produce un control humoral mediante adrenalina y noradrenalina que están habitualmente elevadas en los ancianos tanto en decúbito como en el ortostatismo. Las concentraciones de renina, angiotensina y vasopresina se elevan durante la estimulación el reflejo barorreceptor, apareciendo una respuesta exagerada de liberación de vasopresina durante la hipotensión postural.
Bibliografía
- Campuzano R., Moya J. L., García-Lledó A., Salido L., Guzmán G., Tomas J. P. Asociación de la disfunción endotelial y el grosor mediointimal carotídeo con los factores de riesgo coronario en pacientes sin evidencia clínica de aterosclerosis. Rev. Esp. Cardiol. 2003;56:546-554.
- Cheng L., Mantile G., Pauly R., Nater C., Felici A., Monticone R., Bilato C., Gluzband Y. A., Crow M. T. , Stetler-Stevenson W., Capogrossi M. C. Adenovirus-mediated gene transfer of the human tissue inhibitor of metalloproteinase-2 blocks vascular smooth muscle cell invasiveness in vitro and modulates neointimal development in vivo. Circulation. 1998;98:2195-2201.
- Dart A. M., Kingwell B. A. Pulse pressure: a review of mechanisms and clinical relevance. J. Am. Coll. Cardiol. 2001;37:975-984.
- De Caterina R., Libby P., Peng H. B., Thannickal V. J., Rajavashisth T. B., Gimbrone M. A. Jr, Shin W. S., Liao J. K. Nitric oxide decreases cytokine-induced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines. J. Clin. Invest. 1995;96:60-68.
- Fagerberg B., Bondjers L., Nilsson P. Low birth weight in combination with catch-up growth predicts the occurrence of the metabolic syndrome in men at late middle age: the Atherosclerosis and Insulin Resistance study. J. Intern. Med. 2004;256:254-259.
- Fleg J. L., Shapiro E. P., O’Connor F., Taube J., Goldberg A. P., Lakatta E. G. Left ventricular diastolic filling performance in older male athletes. JAMA. 1995;273:1371-1375.
- Ford G. A. Ageing and the baroreflex. Age Ageing 1999; 28: 337-338.
- Gimbrone M. A. Jr. Endothelial dysfunction, hemodynamic forces, and atherosclerosis. Thromb Haemost. 1999;82:722-726.
- Gerstenblith G., Frederiksen J., Yin F. C., Fortuin N. J., Lakatta E. G., Weisfeldt M. L. Echocardiographic assessment of a normal adult aging population. Circulation. 1977;56:273-278.
- Hansson G. K. Mechanisms of disease: inflammation, atheosclerosis, and coronary artery disease. New Engl. J. Med. 2005;352:1685-1695.
- Hernández J. P., Franke W. D. Age- and fitness-related differences in limb venous compliance do not affect tolerance to maximal lower body negative pressure in men and women. J. Appl. Physiol. 2004;97:925-929.
- Inserra F., Romano L., Ercole L., de Cavanagh E. M., Ferder L. CV changes by long-term inhibition of the renin-angiotensin system in aging. Hypertension. 1995;25:437-442.
- Jenkins G. M., Crow M. T., Bilato C., Gluzband Y., Ryu W. S., Li Z., Stetler-Stevenson W., Nater C., Froehlich J. P., Lakatta E. G., Cheng L. Increased expression of membrane-type matrix metalloproteinase and preferential localization of matrix metalloproteinase-2 to the neointima of balloon-injured rat carotid arteries. Circulation. 1998;97:82-90.
- Jialal I., Devaraj S., Venugopal S. K. C-reactive protein: risk marker or mediator in atherothrombosis? Hypertension. 2004;44:6-11.
- Johnson K. E. CV system. En: Histology and embriology. Johnson K. E. (editor). John Wiley & Sons. New York. 1984;109-118.
- Kroger K., Ose C., Rudofsky G., Roesener J., Weiland D., Hirche H. Peripheral veins: influence of gender, body mass index, age and varicose veins on cross-sectional area. Vasc. Med. 2003;8:249-255.
- Lakatta E. G. CV regulatory mechanisms in advanced age. Physiol. Rev. 1993;73:413-465.
- Lakatta E. G, Levy D. Arterial and cardiac aging: Major Shareholders in CV disease enterprises. Part I: aging arteries: a “set up” for vascular disease. Circulation. 2003;107: 139-146.
- Lee R. T., Yamamoto C., Feng Y., Potter-Perigo S., Briggs W. H., Landschulz K. T., Turi T. G., Thompson J. F., Libby P., Wight T. N. Mechanical strain induces specific changes in the synthesis and organization of proteoglycans by vascular smooth muscle cells. J. Biol. Chem. 2001;276:13847-13851.
- Libby P., Ridker P. M., Maseri A. Inflammation and atherosclerosis. Circulation. 2002;105:1135-1143.
- Matturri L., Ottaviani G., Corti G., Lavezzi A. M. Pathogenesis of early atherosclerotic lesions in infants. Pathol. Res. Pract. 2004;200:403-410.
- O’Leary D. H., Polak J. F., Kronmal R. A., Manolio T. A., Burke G. L., Wolfson S. K. Jr. Carotid-artery intima and media thickness as a risk factor for myocardial infarction and stroke in older adults. CV Health Study Collaborative Research Group. N. Engl. J. Med. 1999;340:14-22.
- Olsen H., Lanne T. Reduced venous compliance in lower limbs of aging humans and its importance for capacitance function. Am. J. Physiol. 1998;275:H878-886.
- Paciaroni E., Fraticelli A. Left ventricular hypertrophy. Prevalence in older patients and management. Drugs Aging. 1995;6:301-311.
- Pauly R. R., Passaniti A., Bilato C., Monticone R., Cheng L., Papadopoulos N., Gluzband Y. A., Smith L., Weinstein C., Lakatta E. G. Migration of cultured vascular smooth muscle cells through a basement membrane barrier requires type IV collagenase activity and is inhibited by cellular differentiation. Circ. Res. 1994;75:41-54.
- Rosei E. A., Muiesan M. L. Early target organ damage and its reversibility: the heart. Clin. Exp. Hypertens. 2004;26:673-687.
- Sartore S., Chiavegato A., Franch r., Faggin E., Paulette P. Myosin expression and cell phenotypes in vascular smooth muscle during development, in experimental models and in vascular disease. Arterioscler. Thromb. Vasc. Biol. 1997; 17: 1210-1215.
- Sata M., Saiura A., Kunisato A., Tojo A., Okada S., Tokuhisa T., Hirai H., Makuuchi M., Hirata Y., Nagai R. Hematopoietic stem cells ifferentiate into vascular cells that participate in the pathogenesis of atherosclerosis. Nat. Med. 2002;8:403-409.
- Shah G. N., Mooradian A. D. Age-related changes in the blood-brain barrier. Exp. Gerontol. 1997;32:501-519.
- Smit A. A. J., Halliwill J. R., Low P. A., Wielin W. Pathophysiological basis of orthostatic hypotension in autonomic failure. J. Physiol. 1999;519:1-10.
- Spagnoli L. G., Orlandi A., Mauriello A., Santeusanio G., de Angelis C., Lucreziotti R., Ramacci M. T. Aging and atherosclerosis in the rabbit. 1. Distribution, prevalence and morphology of atherosclerotic lesions. Atherosclerosis. 1991;89:11-24.
- Taddei S., Virdis A., Mattei P., Ghiadoni L., Gennari A., Fasolo C. B., Sudano I., Salvetti A. Aging and endothelial function in normotensive subjects and patients with essential hypertension. Circulation. 1995;91:1981-1987.
- Vaitkevicius P. V., Fleg J. L. , Engel J. H., O’Connor F. C., Wright J. G., Lakatta L. E., Yin F. C., Lakatta E. G. Effects of age and aerobic capacity on arterial stiffness in healthy adults. Circulation. 1993;88:1456-1462.
- Verdecchia P., Angeli F. Reversal of left ventricular hypertrophy: what have recent trials taught us? Am. J. Cardiovasc. Drugs. 2004;4:369-378.
- Zheng F., Plati A. R., Potier M., Schulman Y., Berho M., Banerjee, Leclrecq B., Zisman A., Striker L. J., Striker G. E. Resistence to glomerulosclerosis in B6 mice dissapears after menopause. Am. J. Pathol. 2003;162:1339-1348.