• MC-F-013. Capítulo 13. Envejecimiento músculo-esquelético.
13.1 El tejido óseo. Recuerdo anatomofisiológico
El hueso está constituido por una matriz orgánica que contiene fibras de colágeno (fundamentalmente de tipo I) y material interfibrilar, sobre la que se deposita el mineral óseo, que está compuesto esencialmente por sales de fosfato cálcico (cristal de hidroxiapatita). El material interfibrilar lo componen una serie de proteínas de menor tamaño que el colágeno, entre las que se encuentran la osteocalcina, que es la más abundante, la osteonectina, algunas fosfoproteínas, sialoproteínas, factores de crecimiento y proteínas séricas. Las células de este tejido son los osteoblastos, los osteocitos y los osteoclastos (Baron, 2003).
La disposición de las fibras colágenas permite diferenciar dos tipos de tejido: uno maduro o laminar y otro inmaduro o fibroso, también llamado plexiforme. El hueso del adulto es, en su mayor parte, de tipo laminar, y se caracteriza porque en él las fibras de colágeno se ordenan configurando láminas óseas que pueden disponerse en cilindros concéntricos alrededor de un canal (conductos de Havers), como sucede en el hueso cortical o compacto, o formar un entramado de tabiques que se orientan según las líneas de fuerza, entre los que quedan unos huecos que están ocupados por el tejido hemopoyético (hueso trabecular o esponjoso). El hueso compacto forma la diáfisis de los huesos largos, y la capa externa de las metáfisis y de las epífisis de lo huesos largos, así como la capa externa de los huesos cortos o planos. El interior de todas estas estructuras óseas está constituido por el tejido trabecular. El hueso cortical está recubierto en su superficie externa por el periostio y en su cara interna por el endostio. Los conductos de Havers y las trabéculas también se hallan recubiertas por endostio. El hueso que se forma rápidamente durante el crecimiento o en los lugares de reparación de las fracturas es el llamado hueso fibroso o inmaduro. Está constituido por fibras colágenas orientadas erráticamente, una matriz rápidamente mineralizada y osteocitos distribuidos irregularmente. Se trata de un tejido temporal, que, en condiciones normales, se reabsorbe rápidamente y es sustituido por hueso laminar (Arnett, 2004).
13.2 Remodelación ósea
El hueso está sometido a un proceso continuo de renovación que se conoce con el nombre de remodelación ósea. Este proceso se lleva a cabo mediante la destrucción por los osteoclastos de pequeñas unidades microscópicas de tejido, dispersas por el esqueleto, denominadas unidades de remodelación ósea (BRU, bone remodeling units), que son posteriormente sustituidas por tejido nuevo formado por los osteoblastos. El proceso comienza cuando acuden a un determinado foco los precursores de los osteoclastos (fase de activación) que al transformarse en osteoclastos maduros comienzan a resorber hueso (fase de resorción), labrando una cavidad tuneliforme en el hueso cortical (cono de apertura) o lacunar en el trabecular (laguna de Howship), que tras un periodo de aparente inactividad (fase de inversión), será rellenada por el nuevo tejido formado por los osteoblastos. Inicialmente los osteoblastos forman la matriz orgánica (osteoide), que se mineraliza unos 15 días después (fase de formación) (Baron, 2003) (Figura 1).
Figura 1. Fases de la remodelación ósea (adaptado de Olmos, 2004).
El proceso de remodelación se lleva a cabo en las superficies óseas, fundamentalmente en la endostal y, en condiciones normales, el 75% de las superficies del hueso trabecular y alrededor del 95% del cortical se encuentran en reposo. La diferencia entre la cantidad de hueso que se destruye y la que se forma en cada una de las BRU se conoce como balance óseo, siendo su valor igual a cero hasta los 30-40 años, y de aproximadamente –3% a partir de esta edad. La velocidad de renovación ósea, o lo que es lo mismo, el volumen de hueso renovado en la unidad de tiempo, se conoce con el término de recambio óseo (turnover). Cuando las BRU se encuentran en equilibrio negativo, un aumento de su número, y por lo tanto, del recambio, supone un incremento en las pérdidas óseas totales. Cuando hay una adecuada coordinación temporal y espacial entre la activación de los osteoblastos y los osteoclastos se dice que existe un acoplamiento entre ambos (Mundy, 2003).
13.2.1 Descripción del ciclo de remodelación ósea
En el ciclo de renovación ósea cabe distinguir cuatro fases: activación, resorción, inversión y formación. La activación comienza con el reclutamiento de los pre-osteoclastos, los cuales proliferan, se diferencian y se fusionan, para formar las grandes células multinucleadas que constituyen los osteoclastos maduros. El fenómeno de activación es consecuencia de la intervención de una serie de “señales” no bien conocidas, entre las que deben figurar cambios en las fuerzas mecánicas locales, cambios en la situación endocrinológica general del individuo, cambios en el ambiente paracrino del lugar que va a ser remodelado, y cambios en la propia estructura ósea surgidos como consecuencia del envejecimiento o del sufrimiento de un daño.
Antes de que comience la fase de resorción, los osteoclastos deben fijarse al hueso. Para ello, los osteoblastos de revestimiento se retraen dejando huecos a través de los cuales pasan los osteoclastos. Tras establecer contacto con la matriz ósea, las células osteoclásticas se fijan al hueso gracias a la afinidad de una integrina presente en la superficie de los osteoclastos (la avb3) por determinadas proteínas de la matriz ósea (vitronectina, fibronectina). Tal unión se sigue de la activación en el osteoclasto de la quinasa p60c-src, molécula que interviene en la organización del citoesqueleto del osteoclasto, lo que permite a estas células adoptar la típica configuración que caracteriza al osteoclasto activo, con el borde rugoso o “fruncido”, y un anillo rico en filamentos de actina que rodea a la zona rugosa, y que al unirse a la matriz, sella el espacio que queda entre ambas (zona rugosa del osteoclasto y matriz), aislándolo del microambiente óseo. Tras fijarse a las superficies óseas, los osteoclastos maduros comienzan a resorber hueso. El mecanismo principal de disolución del componente mineral, que precede al de las fibras colágenas, está mediado por la secreción de hidrogeniones (H+) a la zona sellada a través de un mecanismo de transporte activo ATPasa-dependiente. Los H+ proceden de la transformación previa de CO2 y H2O en CO3H2, gracias a la acción de la anhidrasa carbónica, enzima presente en los osteoclastos. La secreción de H+ facilita la disolución del cristal de hidroxiapatita y, además, crea las condiciones de pH idóneas (pH: 4,5) para que actúen las enzimas lisosomales que disuelven la matriz orgánica. La más importante de ellas es la catepsina K, aunque también colaboran en este proceso otras proteinasas como las metaloproteinasas 2, 9 y 13 que se encuentran enterradas en la matriz, por lo que también se las conoce con el nombre de matrixinas. Las sustancias liberadas del hueso pasan al interior del osteoclasto, que las procesa. Tras finalizar su actuación, los osteoclastos desaparecen por apoptosis (Figura 2) (Baron, 2003; Mundy, 2003).
Figura 2. Resorción ósea. Cath K: Catepsina K (elaboración propia).
Una vez finalizado el fenómeno de resorción, la superficie ósea queda libre de células, excepto por la presencia de unos pocos fagocitos mononucleares cuya estirpe se ha venido considerando macrofágica, aunque podría ser osteoblástica, y que, además de limpiar la cavidad, tiene la función de formar la línea de cementación sobre la que se depositará el hueso nuevo. Es la fase de inversión, durante la cual probablemente se establecen señales que reclutan osteoblastos. Tras este periodo de aparente inactividad van llegando al hueso los precursores de los osteoblastos que proliferan y se diferencian a osteoblastos maduros llenando con nuevo tejido óseo el hueco previamente labrado por los osteoclastos. No se conocen con exactitud los mecanismos íntimos que determinan el acoplamiento entre los osteoblastos y los osteoclastos, aunque se cree que intervienen algunos factores de crecimiento que, enterrados en la matriz ósea al formarse la misma, son liberados desde ella cuando es destruida. Se desarrolla así la cuarta fase o de formación en la que los osteoblastos sintetizan y depositan la matriz osteoide que posteriormente se mineralizará. Se considera que aproximadamente la mitad de los osteoblastos formadores de hueso mueren por apoptosis. La otra mitad, o bien se transforma en osteoblastos de superficie (células de recubrimiento) recubriendo el hueso recién formado, o bien, a medida que forman hueso, quedan enterrados en él, transformándose en osteocitos.
Los osteocitos se mantienen en contacto entre sí y con las células de la superficie ósea mediante una red de prolongaciones citoplasmáticas alojada en un sistema canalicular existente en el seno del tejido óseo.
Tanto los osteoclastos como los osteoblastos se originan en la médula ósea. Los precursores de los osteoclastos son de estirpe hematopoyética, mientras que los de los osteoblastos pertenecen al mesénquima (estroma) de la médula. Los precursores de los osteoclastos no pueden desarrollarse en ausencia de las células del estroma, hecho conocido desde hace años, pero al que sólo se ha encontrado explicación recientemente, con la descripción del sistema RANK-RANKL-OPG.
13.2.2 Regulación de la remodelación ósea
Los factores que regulan el proceso de remodelación ósea sólo se conocen de modo parcial. Probablemente existen factores de naturaleza física (estímulos mecánicos y piezoeléctricos), dado que la inactividad física condiciona una pérdida de masa ósea. Para algunos autores existiría un “mecanostato”, o sistema capaz de regular la cantidad de masa ósea en función, por una parte, de la sobrecarga mecánica detectada, y, por otra, de las necesidades de resistencia del momento (Erlich y Lanyon, 2002). Sin embargo, los factores reguladores de la remodelación mejor conocidos son los de carácter humoral. Estos, a su vez, pueden ser sistémicos (factores hormonales) o locales (factores paracrinos). Dentro de los primeros se engloban las hormonas calciotropas (parathormona –PTH–, 1,25-(OH)2-D3 o calcitriol y calcitonina) y otras hormonas que no están relacionadas específicamente con el metabolismo mineral, entre las que se encuentran las hormonas sexuales (estrógenos y andrógenos), la hormona de crecimiento (GH), la hormona tiroidea y los glucocorticoides.
13.2.2.1 Factores hormonales
La PTH favorece la activación de los osteoclastos y secundariamente la de los osteoblastos, aumentando el recambio óseo. No obstante, el equilibrio final es ligeramente negativo, por lo que el resultado global de la PTH sobre la masa ósea es perjudicial. Sin embargo, cuando la acción de la PTH es intermitente, el efecto es positivo. Se cree que los osteoclastos maduros no responden a la PTH directamente, sino a través de las señales que envían las células de estirpe osteoblástica, que poseen receptores para esta hormona. Hoy se sabe que los osteoclastos y preosteoclastos expresan receptores para la PTH, por lo que no puede excluirse la posibilidad de un efecto directo de esta hormona.
El calcitriol ejerce también un efecto estimulador sobre la resorción ósea. Los osteoclastos no poseen receptores para el calcitriol (aunque sí sus precursores), por lo que sus efectos parecen estar mediados por células intermediarias, como los osteoblastos, que sí los poseen. Por otro lado, el calcitriol favorece la mineralización ósea al estimular la absorción intestinal de calcio y fósforo. También promueve la actividad y diferenciación de los osteoblastos, probablemente a través del sistema OPG/RANKL y además, inhibe la secreción de PTH. En cualquier caso, conviene recordar que el resultado final del calcitriol sobre la masa ósea es favorable. Finalmente, la calcitonina ejerce un efecto inhibidor directo sobre los osteoclastos, que poseen receptores para esta hormona, aunque se desconoce la trascendencia de su actuación, tanto en condiciones fisiológicas como patológicas (González Macías y Olmos 2005).
Entre las hormonas inespecíficas hay que considerar a las hormonas sexuales (estrógenos y andrógenos) y a la GH, que ejercen un efecto anabólico sobre el tejido musculoesquelético. Las hormonas sexuales son imprescindibles para el normal desarrollo del esqueleto. Se piensa que los estrógenos desempeñan un papel esencial durante la fase de crecimiento, no sólo en las mujeres, sino también en los varones. En los individuos adultos los esteroides sexuales siguen ejerciendo una influencia anabólica sobre el esqueleto, al actuar favoreciendo la formación y, sobre todo, inhibiendo la resorción ósea. Buena prueba de ello es la pérdida de masa ósea que se produce tras el cese de la actividad ovárica en las mujeres postmenopáusicas, o tras el bloqueo de la producción de andrógenos en los varones. La ausencia de estrógenos da lugar a un aumento de los osteoclastos –y secundariamente de los osteoblastos– con un incremento del recambio óseo. Se discute la mayor o menor trascendencia de su actuación directa –a través de los receptores de las células óseas para los estrógenos– y de la indirecta, a través de algunos de los factores locales que comentaremos a continuación (IL-1, TNF-a, IL-6, prostaglandinas –PGs–, RANKL/OPG). Se han descrito dos tipos de receptores de los estrógenos, el receptor estrogénico alfa (ERa) y el beta (ERb); el primero se ha identificado tanto en células de estirpe osteoblástica como osteoclástica, mientras que el segundo sólo se ha descrito en osteoblastos. Es posible que en ambos tipos celulares, los estrógenos desarrollen efectos no genómicos. Por otra parte se ha sugerido que en el efecto protector de estas hormonas sobre el hueso intervenga un fenómeno de “disminución de la sensibilidad” del mismo a la PTH.
También en los varones, tanto los estrógenos como los andrógenos parecen desempeñar un importante papel en el mantenimiento del esqueleto. Los andrógenos, no sólo sirven como sustrato a la producción periférica de estrógenos, sino que ejercen una influencia positiva directa sobre el esqueleto y tienden a favorecer la proliferación de los precursores osteoblásticos y la producción de factores de crecimiento, como el factor de crecimiento similar a la insulina tipo 1 (IGF-1) al que luego nos referiremos y, al igual que los estrógenos, inhiben la apoptosis de los osteoblastos. Un efecto diferencial de los andrógenos, no compartido por los estrógenos, es el incremento de la aposición subperióstica. Ello explica que los huesos de los varones sean más anchos que los de las mujeres y tengan corticales más gruesas (Seeman, 2003).
La hormona de crecimiento (GH) estimula el crecimiento longitudinal óseo en la fase de desarrollo. A pesar de que se han descrito efectos directos de la GH sobre las células óseas, la mayor parte de sus efectos biológicos son mediados por el factor de crecimiento similar a la insulina tipo 1 (IGF-1). Más del 75% del IGF-1 sérico es producido en el hígado por estímulo de la GH, aunque el esqueleto es la segunda fuente de IGF-1. De hecho, el IGF-1 es el factor de crecimiento más abundante en el tejido óseo, tanto si se considera su producción como su almacenamiento en la matriz proteica. Su papel en la función de las células de linaje osteoblástico está claramente establecido: estimula la proliferación, diferenciación y mineralización de la matriz y disminuye la degradación del colágeno (Mezquita, 2004).
Finalmente, el exceso de glucocorticoides y de hormonas tiroideas ejerce un efecto deletéreo sobre el esqueleto. Es bien conocido que los glucocorticoides reducen la absorción intestinal del calcio y favorecen su excreción renal, lo que determina un aumento de la secreción de PTH con la consiguiente activación de la resorción ósea. Por otra parte, los esteroides actúan directamente sobre los osteoblastos, inhibiendo la replicación y diferenciación de estas células, y favoreciendo su apoptosis y la de los osteocitos. Además, reducen su actividad funcional, inhibiendo la síntesis de algunas proteínas de la matriz ósea (disminuyen la transcripción de los genes del colágeno tipo I, osteocalcina, fosfatasa alcalina y osteonectina). También favorecen la degradación del colágeno ya formado.
El efecto negativo de los glucocorticoides sobre el esqueleto puede guardar también relación con la disminución de las hormonas sexuales y con la modulación de la síntesis y liberación de algunos factores locales. Por ejemplo, inhiben la síntesis de IGF-1 y la del receptor del IGF-2, e impiden la acción del factor transformante beta (TGF-b) con lo que se bloquea su acción estimuladora de los osteoblastos. También disminuyen la expresión del factor de transcripción Runx2/Cbfa1 que desempeña un papel esencial en la diferenciación y activación de los osteoblastos. Por último, recientemente se ha señalado que los glucocorticoides aumentan la expresión del ligando del receptor activador del factor nuclear k-B (RANKL) y disminuyen los niveles de osteoprotegerina (OPG), favoreciendo con ello la activación y diferenciación de los osteoclastos (Canalis, 2003).
Las hormonas tiroideas son necesarias para el reclutamiento, la maduración y la actividad de osteoblastos y osteoclastos. Actúan directamente sobre estas células óseas, modulan el proceso de remodelación e inducen cambios secundarios en las concentraciones de calcio, PTH y vitamina D. Sin embargo, el exceso de hormona tiroidea provoca un aumento del turnover óseo con predominio de la resorción (Mezquita, 2004).
13.2.2.2 Factores locales
La importancia de las influencias hormonales sobre el esqueleto es evidente. Pero el hecho de que en un momento dado sólo algunos puntos concretos del mismo estén siendo objeto de remodelación, indica que deben existir factores locales moduladores de este proceso. Algunos de estos factores reguladores locales o paracrinos han comenzado a conocerse en los últimos años, aunque su trascendencia real aún no está bien establecida (Mundy, 2003). Pueden encontrarse preformados en la matriz ósea, siendo liberados durante el proceso de resorción, o ser sintetizados de novo por los osteoblastos o por las células inmunes. Actúan atrayendo hacia el foco en que se inicia la remodelación a los precursores de los osteoclastos, induciendo su proliferación y diferenciación y estimulando su actuación. También actúan sobre los osteoblastos. Con frecuencia, los factores locales actúan sobre más de un aspecto, y el efecto puede ser incluso bifásico.
En la Tabla 1 se presenta, aun a riesgo de ser simplistas una relación de diversos factores que actúan en la remodelación ósea.
|
FACTORES ESTIMULANTES DE LA RESORCIÓN ÓSEA |
FACTORES ESTIMULANTES DE LA FORMACIÓN ÓSEA |
|
· Prostaglandinas (PGE2). · Leucotrienos. · Interleuquinas (IL-1, IL-3, IL-6 ,IL-11, IL-17). · Factores de necrosis tumoral (TNF-a, TNF-b). · Factores estimulante de colonias: – Granulocíticas-macrofágicas (GM-CSF). – Macofagicas (M-CSF). · Factor inhibidor de la leucemia (LIF). |
· Interleuquina 4 (IL-4). · Factor transformante beta (TGF-b). · Proteínas morfogenéticas del hueso (BMP). · Factor de crecimiento fibroblástico (FGF). · Factor de crecimiento derivado de plaquetas (PDGF). · Interferón gamma (IFN-g). · Factores de crecimiento similares a la insulina: – IGF-1. – IGF-2. |
Tabla 1. Factores estimulantes de la resorción y de la formación ósea (elaboración propia).
Es probable que no todos estos factores actúen en la misma fase, sino que más bien vayan haciéndolo a medida que en la evolución del osteoblasto van siendo precisas unas u otras modificaciones funcionales (por ejemplo, el TGF-b probablemente estimula la proliferación de los precursores, las bone morphogenetic proteins –BMP– la diferenciación, etc.). Ello no significa que alguno de estos factores no pueda actuar en más de una fase. Los factores que estimulan a los osteoblastos pueden inhibir a los osteoclastos: por ejemplo, el TGF-b parece inducir en los osteoclastos un fenómeno apoptótico, responsable de su desaparición en el foco de resorción, para dar paso a la fase formativa. Por otra parte, el TGF-b inhibe la apoptosis osteoblástica (González Macías y Olmos, 2005).
Los factores locales son producidos por células óseas, células sanguíneas (monocitos y linfocitos) y células de la médula ósea, incluidas las del estroma medular. La producción de estos factores puede verse regulada por hormonas sistémicas. El caso de mayor interés es el de la relación de los estrógenos con la IL-1, IL-6, y el TNF-a, a los que inhibe, y el TGF-b, al que estimula. Además, en la regulación de su síntesis intervienen elementos de la matriz ósea liberados durante la resorción, como fragmentos del colágeno (Manolagas, 2000).
Por último, conviene señalar que estos factores actúan modulando la acción del denominado sistema RANK/RANKL/OPG antes mencionado. Desde hace unos años se sabe que en la formación de los osteoclastos intervienen células inmaduras de estirpe osteoblástica, las cuales poseen en su membrana una proteína (RANKL, o ligando del RANK) capaz de unirse a un receptor de la familia del TNF (RANK, receptor activador del factor nuclear k-B) presente en los preosteoclastos y osteoclastos. Dicha unión determina la puesta en marcha en estas células de fenómenos de diferenciación y activación, así como de inhibición de la apoptosis. Por otra parte, las mismas células inmaduras de estirpe osteoblástica que expresan en su superficie el RANKL, producen y segregan una proteína denominada osteoprotegerina (OPG), con afinidad por éste. La unión de la OPG al RANKL impide el acceso del mismo al RANK, y por tanto la diferenciación y la activación osteoclástica (Figura 3) (Hofbauer, 2000).
Figura 3 (izquierda). Esquema general del sistema RANK/RANKL/OPG. OB: osteoblastos; ST: células estromales; M-CSF: factor estimulante de colonias macrofágicas; Pre-OC: preosteoclasto; OC maduro: osteoclasto maduro (elaboración propia).
Figura 3 (derecha). Relación entre los factores sistémicos y locales y el sistema RANK/RANKL/OPG. BMPs: proteínas morfogenéticas del hueso; TGF-b: factor de crecimiento transformante b; PGs: prostaglandinas; CT: calcitonina; M-CSF: factor estimulante de colonias macrofágicas (elaboración propia).
También se ha comprobado que los genes que codifican la OPG y el RANKL tienen en común el poseer lugares de unión para un factor de transcripción denominado Runx2/Cbfa1 que desempeña un papel esencial en la diferenciación y activación de los osteoblastos, lo que podría explicar el acoplamiento entre las células que interviene en la resorción y la formación del tejido óseo (Gutiérrez, 2004).
13.3 Cambios en el hueso
A partir de los 40 años se produce una pérdida progresiva de masa ósea con la edad que aumenta en las mujeres durante los años que siguen al cese de la actividad ovárica (Figura 4).
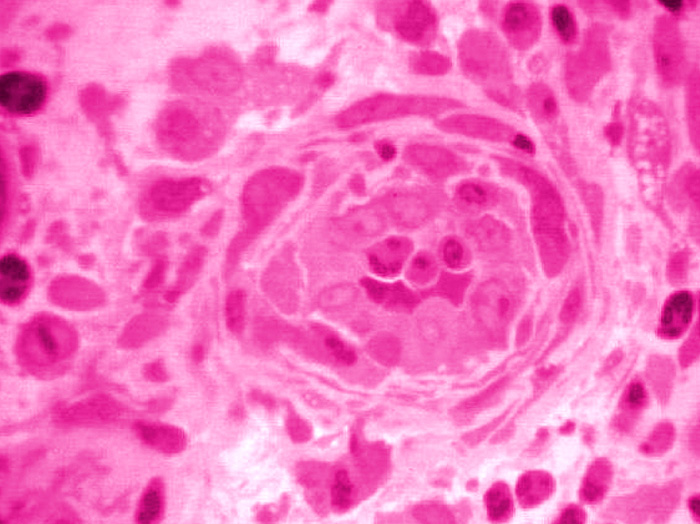
Figura 4. Patrón de pérdida de masa ósea con la edad (autor desconocido).
La pérdida de hueso afecta tanto al hueso trabecular (predominante en el esqueleto axial) como al cortical (predominante en el esqueleto apendicular), produciéndose un adelgazamiento de las trabéculas y la perforación y pérdida de conectividad de las mismas en el primer caso, y la disminución del grosor de la cortical y el aumento de su porosidad en el segundo. Se ha calculado que, a lo largo de la vida, las mujeres pierden más del 40% de la masa ósea en columna y casi un 60% de la cadera (Rosen y Kiel, 2003). Estos cambios son debidos a la existencia de modificaciones en el funcionamiento de las unidades de remodelación que describiremos a continuación.
13.3.1 Modificaciones en el funcionamiento de las unidades de remodelación ósea
La remodelación ósea puede sufrir diversos tipos de modificaciones. En primer lugar porque lo haga el balance de las unidades de remodelación. El mantenimiento de la masa ósea exige que la cantidad de hueso destruida por los osteoclastos y la formada por los osteoblastos sean iguales. Cuando en cada unidad se forma menos hueso del que se destruye (balance negativo), la masa ósea disminuye. Tal negatividad puede deberse al sufrimiento por los osteoblastos de la pérdida de la capacidad de replicación celular que acompaña en general al envejecimiento, en relación con el acortamiento telomérico, aunque la trascendencia de este fenómeno no puede asegurarse (Gronthos, 2000). En algunos modelos murinos se ha descrito la existencia de una disminución en el número de precursores osteoblásticos y del reclutamiento y proliferación de los mismos. También en estudios realizados in vitro con osteoblastos humanos se ha observado que los procedentes de personas ancianas presentan una menor capacidad proliferativa y responden peor ante diversos estímulos hormonales y paracrinos que los de los jóvenes (Munuera, 2001). Otro factor que podría influir en la pérdida de la capacidad proliferativa es el descenso de IGF-1 que tiene lugar con la edad y al que más adelante nos referiremos (Langlois, 1998). Este balance negativo, estimado en un 3% en cada unidad de remodelación, es el responsable de la pérdida fisiológica de masa ósea que se produce con la edad, y que facilita el desarrollo de osteoporosis en los ancianos.
Otra posibilidad es que se produzca un aumento del recambio óseo. Dicho aumento suele producirse a expensas de un aumento en el número de unidades de remodelación, o de un incremento en la actividad de las mismas. Cuando las unidades de remodelación están en situación de balance negativo, un aumento en su número determina una intensificación de la pérdida ósea. Esto es lo que ocurre tras el cese de la actividad ovárica, y es el fenómeno principalmente implicado en la patogenia de la osteoporosis postmenopáusica. El aumento del recambio tiene además otras repercusiones desfavorables para el hueso. Puesto que cada unidad supone la existencia de un espacio libre de hueso, el aumento del recambio se traduce en un aumento del número total de tales espacios, y en definitiva del llamado “espacio óseo en remodelación”. Además, el aumento de actividad de los osteoclastos facilita el adelgazamiento y perforación de las trabéculas, con la consiguiente desconexión de las mismas. Este fenómeno incrementa exponencialmente la fragilidad esquelética. En el hueso cortical, demasiado grueso para ser perforado por los osteoclastos, el fenómeno sólo llega a afectar al endostio, en que los osteoclastos pueden atravesar el sistema de Havers y alcanzar la médula ósea. Si el fenómeno es suficientemente intenso, la acumulación de múltiples perforaciones puede dar lugar a lo que se denomina “trabeculación” del endostio y su consecuencia es un adelgazamiento de la cortical. En el espesor del hueso cortical el aumento del número de unidades de remodelación y el balance negativo de las mismas se traduce en un incremento de la porosidad (Arnett, 2004; González Macías y Olmos, 2005).
A diferencia de lo que ocurre en las mujeres con la menopausia, los varones no experimentan un cese brusco de la síntesis gonadal de esteroides sexuales, por lo que no se produce un periodo acelerado de pérdida de masa ósea similar al que aparece en las mujeres tras la menopausia. Existen otras alteraciones del fenómeno de remodelación esquelética –falta de mineralización, pérdida del acoplamiento, formación de hueso plexiforme–, que comentaremos más adelante.
13.3.2 Factores determinantes de las modificaciones en la remodelación
Las alteraciones en el funcionamiento de las unidades de remodelación que hemos comentado guardan relación con diversos factores que clasificaremos en nutricionales, hormonales, paracrinos, mecánicos y genéticos (Raisz y Seeman, 2001).
13.3.2.1 Factores nutricionales
Las deficiencias de calcio y/o vitamina D constituyen probablemente los factores más relevante en los ancianos. El calcio, junto con el fósforo, son constituyentes de la fase mineral del hueso que, depositados sobre las proteínas de la matriz ósea, dan rigidez al tejido y le confieren sus propiedades mecánicas y de sostén. Cuando disminuye el calcio ingerido con la dieta, desciende la absorción de calcio y baja la calcemia. Ello, estimularía la secreción de PTH, que aumentaría la reabsorción ósea, la reabsorción renal de calcio y la producción renal de calcitriol. Éste aumentaría la absorción intestinal y reabsorción tubular de calcio y, en el hueso, favorecería la acción resortiva de la PTH (Lips, 2001). El balance entre entradas y salidas del organismo tendería a ser neutralizado, con estabilidad de los valores plasmáticos de calcio, pero a expensas de un balance negativo del mismo en el hueso (McKane, 1996) (Figura 5).
Figura 5. Consecuencias del déficit de calcio y vitamina D en los ancianos (elaboración propia).
Es bien conocido que la ingesta de calcio suele ser insuficiente en la mayoría de los ancianos. Tanto en España como en otros países de nuestro entorno la ingesta media de calcio se sitúa en alrededor de los 800 mg/día, cifra muy alejada de los 1.500 mg/día que se considera actualmente como la dosis recomendada a esta edad (Torrijos, 2001). Además de la disminución en la ingesta, los ancianos también presentan una menor absorción intestinal de calcio y una mayor pérdida del mismo con la orina (Rosen y Kiel, 2003; Mosekilde, 2005). Todo ello contribuiría a explicar el aumento en las concentraciones de PTH y de los marcadores de resorción que se observa en un elevado porcentaje de personas mayores. De hecho, se ha comprobado que la administración de calcio en dosis altas (2.400 mg/día x 3 años) a mujeres mayores de 65 años consigue reducir los niveles de PTH y de los marcadores de resorción a valores similares a los de las mujeres premenopáusicas (Heaney, 1996).
En cuanto a la vitamina D, cada vez hay más datos que señalan que su déficit puede ser más prevalente de lo que se pensaba, especialmente en los individuos de mayor riesgo, como los ancianos (Mosekilde, 2005). Se ha señalado que alrededor del 30% de la población adulta española podría ser deficiente en vitamina D (Quesada, 1998; Quesada, 2004). Estas cifras podrían ser todavía mayores en nuestros ancianos, especialmente en los meses de invierno y en los que viven en residencias. Se ha señalado que el tratamiento con dosis suficientes de calcio (1.200 mg/día) y vitamina D (800 UI/día) puede reducir la tasa de fracturas de cadera en la población anciana ingresada en residencias (Bischoff-Ferrari, 2005).
Además del calcio y la vitamina D, existen otros factores nutricionales que pueden estar implicados en la pérdida de hueso asociada a la edad. Entre ellos se encuentran la ingesta proteica y el comportamiento alimentario en general. La malnutrición calórico-proteica actúa sobre el hueso directamente, y probablemente también indirectamente a través de otros mecanismos, como la reducción en la secreción de IGF-1. El déficit de vitamina K podría contribuir a aumentar la pérdida de hueso al reducirse sus efectos sobre la carboxilación de algunas proteínas de la matriz ósea como la osteocalcina. Finalmente, se ha señalado que la ingesta excesiva de vitamina A puede provocar una disminución de la masa ósea y un aumento de la incidencia de fracturas. Esta situación se observa sobre todo en ancianos de países anglosajones que acostumbran a ingerir dosis excesivas de complejos polivitamínicos con mayor frecuencia que en nuestro medio (Rosen y Kiel, 2003).
13.3.2.2 Factores hormonales
Ya hemos comentado que las hormonas sexuales y la hormona de crecimiento ejercen un efecto anabólico sobre el hueso. En las mujeres premenopáusicas más del 95% del estradiol se sintetiza en los ovarios. Tras el cese de la actividad ovárica, las pequeñas concentraciones de estradiol que se detectan en la sangre proceden de la transformación en el hígado y otros tejidos (adiposo), de andrógenos como la testosterona o la androstendiona en estrógenos, gracias a la acción enzimática de la CYP19 aromatasa. Durante el periodo fértil cerca del 25% de la testosterona se produce en los ovarios, otro 25% en las suprarrenales y el restante 50% en los tejidos periféricos. Tras la menopausia, la inmensa mayoría de los andrógenos provienen de las suprarrenales.
En los varones, la testosterona es el andrógeno principal y procede en un 95% de la síntesis testicular. A diferencia de lo que sucede con la menopausia, los varones no experimentan un cese brusco de la síntesis gonadal de testosterona. Sin embargo, con la edad se observa una disminución progresiva de la actividad androgénica, que depende de una cierta disminución de la síntesis testicular y, sobre todo, del aumento de los niveles de su proteína transportadora la sex hormone-binding globulin (SHBG), lo que reduce la fracción de testosterona libre, de forma que, entre los 25 y los 75 años, la concentración de testosterona libre se reduce un 50% (Riancho, 2004). Por otra parte, los andrógenos suprarrenales, como la dehidroepiandrostendiona y la dehidroepiandrostendiona-sulfato (DHEA y DHEA-S), también disminuyen de forma manifiesta con la edad, alcanzando sólo el 10-20% de los valores séricos normales en los adultos.
Los cambios en el eje GH-IGF-1 pueden contribuir también a explicar la pérdida de masa ósea en los ancianos. A partir de los 50 años, la secreción de GH disminuye cerca de un 15% cada década y es la principal causa de la disminución en los niveles de IGF-1 que se observa en los ancianos de ambos sexos. También es posible que intervenga la alteración en las proteínas transportadoras de estas sustancias (IGF-BP) (Langlois, 1998).
13.3.2.3 Factores paracrinos
Parece bien establecido que la concentración sérica de osteoprotegerina (OPG) aumenta de forma progresiva con la edad, probablemente para contrarrestar el aumento de la actividad resortiva que presentan las personas ancianas (Mundy, 2003, Baron 2003). Sin embargo, los resultados obtenidos con otros factores locales han sido contradictorios. Por ejemplo, la secreción de IL-1 se ha encontrado aumentada, disminuida o normal en los ancianos (Riancho, 1994). También se han publicado resultados discordantes con otras citoquinas como la IL-3, el interferón gamma, TNF o las prostaglandinas (Riancho, 1994; Rubenof, 1998; Rosen y Kiel, 2003). Estas discrepancias podrían guardar relación con aspectos metodológicos. De todos modos, hay que tener presente que los cambios en la concentración sérica o en la síntesis in vitro de los distintos factores locales pueden no reflejar lo que ocurre en el microambiente óseo.
13.3.2.4 Factores mecánicos
Las tensiones que resultan de las cargas mecánicas son un regulador importante del remodelado en algunas partes del esqueleto. De hecho, parece que los huesos largos y los cuerpos vertebrales necesitan cargas pequeñas, pero frecuentes, para mantener la masa ósea. En último término, la masa y la resistencia del esqueleto viene determinadas por la necesidad de resistir las cargas y las deformidades impuestas por las actividades extremas de la vida diaria (Lanyon y Skerry 2001; Erlich y Lanyon, 2002). Se piensa que los osteocitos intervienen en la respuesta del hueso a los estímulos mecánicos, actuando como mecano-receptores que se comunican con los osteoblastos y osteoclastos presentes en las superficies óseas (Arnett, 2004).
La inactividad física produce una pérdida de masa ósea significativa, mientras que el ejercicio físico provoca el efecto contrario. La actividad física disminuye con la edad, lo que puede contribuir a la menor masa ósea propia del envejecimiento. El reposo prolongado en cama determina una pérdida de masa ósea especialmente marcada, lo que en los ancianos, en que las enfermedades son más frecuentes, puede ser especialmente relevante.
13.3.2.5 Factores genéticos
La pérdida de masa ósea que se observa en algunos individuos puede deberse a otros factores distintos de los nutricionales o hormonales. Algunos autores han sugerido que existiría una programación genética que, activada por factores ambientales, determinaría la pérdida de hueso en los viejos. En algunos modelos animales se ha observado un componente hereditario en la pérdida de masa ósea relacionada con la edad (Halloran, 2002), y existen modelos murinos manipulados genéticamente que desarrollan un cuadro muy similar al de la osteoporosis humana (Ophoff, 2005). En las personas, la multiplicidad de factores ambientales hace difícil conocer la heredabilidad de las fracturas, aunque algún trabajo reciente sugiere la existencia de un componente genético. Por otra parte, los factores ambientales como el tabaco, el alcohol, y algunos medicamentos como los glucocorticoides, pueden lógicamente contribuir a la pérdida de hueso en algunos ancianos (Rosen y Kiel, 2003).
13.4 Cambios en el músculo
La masa corporal magra disminuye entre los 35 y los 80 años, sobre todo debido a la pérdida de masa muscular esquelética. Este proceso se conoce con el nombre de sarcopenia y contribuye de manera evidente a la pérdida de fuerza y actividad funcional en los ancianos (Doherty, 2001). Al igual que sucede con la masa ósea, el pico de masa muscular se alcanza en la juventud, hacia los 25 años, y se mantiene relativamente estable (pérdida de un 10%) hasta los 50 años. Sin embargo, a partir de esta edad hay una pérdida progresiva de músculo que aumenta especialmente a partir de la sexta década de la vida, y que da lugar a la pérdida de un 40% de la masa muscular inicial cuando se alcanzan los 80 años. La pérdida del músculo se debe fundamentalmente a la disminución en el número de fibras musculares, especialmente las de tipo II o de contracción rápida y, en menor medida, a la atrofia de las mismas (Deschenes, 2004). En la patogenia de la sarcopenia parecen intervenir varios factores, como la denervación del tejido muscular, los cambios en el metabolismo proteico o en las concentraciones de diversas hormonas y otros factores que comentaremos a continuación.
13.4.1 Denervación muscular
La denervación muscular provoca en los ancianos una pérdida de unidades motoras y por tanto de fibras musculares. Hasta los 60 años se mantiene aceptablemente el número de unidades motoras, pero a partir de esta edad, se aprecia una progresiva disminución en el número de neuronas motoras del asta anterior de la médula espinal y del número de uniones neuromusculares en los nervios periféricos. Estos cambios anatómicos se reflejan también en los estudios electromiográficos realizados en ancianos, en los que se observa una pérdida del 25% en el número de unidades motoras. Por otra parte, se ha observado que conforme avanza la edad se produce un aumento en la expresión de la molécula de adhesión de las células nerviosas (NCAM) en los músculos de animales de experimentación, un fenómeno que también sucede con los músculos de animales jóvenes sometidos a un proceso de denervación (Deschenes, 2004). No se conocen bien los mecanismos que determinan la aparición de este proceso, aunque cabe la posibilidad de que guarde relación con la disminución en el factor neurotrófico ciliar (CNTF), cuya producción disminuye con la edad en los nervios periféricos y que actúa estimulando la superviviencia de las motoneuronas (Guillet, 1999).
13.4.2 Metabolismo proteico
La alteración en el metabolismo proteico podría explicar la discreta pérdida muscular que aparece antes de los 60 años. A diferencia de lo que ocurre con los procesos de denervación muscular, la síntesis proteica empieza a decaer a partir de los 50 años, aunque posteriormente continua haciéndolo hasta edades más avanzadas. Esta disminución parece guardar relación con la menor disponibilidad de moléculas de ATP en el músculo, debido probablemente a la disminución en el número de mitocondrias y a la afectación del ADN mitocondrial provocado quizás por los fenómenos oxidativos que acompañan al aumento en la producción de radicales libres en los músculos de las personas mayores. (Doherty, 2001; Dirks, 2005).
13.4.3 Factores hormonales
Ya hemos comentado al hablar de los cambios en el hueso, que el envejecimiento se acompaña de una serie de cambios en algunas hormonas que poseen importantes efectos anabólicos sobre el tejido musculoesquelético. En los varones disminuye progresivamente la actividad androgénica, reduciéndose los niveles de testosterona total y libre. Además, la sensibilidad de los distintos tejidos diana, incluido el músculo, disminuye con la edad. Estos trastornos dan lugar a una reducción en la síntesis de las proteínas musculares favoreciendo con ello el desarrollo de la sarcopenia. De hecho, la administración de testosterona mejora la fuerza y la masa muscular en los ancianos, aunque los posibles efectos secundarios de dicho tratamiento limitan su uso. En las mujeres, la caída brusca de los estrógenos contribuye también al desarrollo de la sarcopenia. Sin embargo, el menor desarrollo muscular del sexo femenino y la presencia de andrógenos suprarrenales tras la menopausia hace que este fenómeno sea en ocasiones menos aparente (Deschenes, 2004).
La disminución en la concentración de la hormona del crecimiento (GH) y del IGF-1 contribuiría también a explicar la pérdida de masa muscular en ambos sexos. La disminución de IGF-1 aceleraría la degradación de las proteínas musculares y reduciría la expresión de los receptores dihidropiridínicos (DHPR) y rianodínicos (RyR1) que desempeñan un papel crucial en la regulación del calcio intracelular y en la contractilidad muscular. Así, en algunos estudios utilizando ratones transgénicos que sobreexpresan el IGF-1 se ha observado que, a diferencia de lo que sucede con los ratones normales, la concentración de estos receptores no disminuye con la edad, normalizándose la concentración citosólica de calcio en las fibras musculares (Delbono, 2002).
13.4.4 Factores paracrinos
Al igual que sucede con el tejido óseo, existen algunos factores producidos por el propio músculo que parecen intervenir en el desarrollo de la sarcopenia. Por ejemplo, el IGF-1 sintetizado en el músculo parece estimular la proliferación de las denominadas “células satélites”. Se trata de unas células que están asociadas al sarcolema y que pueden ceder sus núcleos para que se incorporen en el citoplasma de las fibras musculares cuando éstas se hipertrofian. Esta isoforma específica del IGF-1, sintetizada localmente por el tejido muscular, ha recibido el nombre de “factor de crecimiento mecánico” (MGF), debido a que se produce en los músculos cuando se lesionan o son sometidos a una sobrecarga mecánica (Hameed, 2002). Pues bien, el ARNm del MGF está disminuido en los músculos de los ancianos, tanto de forma basal como cuando se les somete a una sobrecarga mecánica. Por otra parte, la administración de este factor a animales de experimentación, así como el desarrollo de animales transgénicos que sobreexpresan el MGF, consigue prevenir la aparición de la sarcopenia, lo que abre nuevas perspectivas en la prevención y tratamiento de este proceso (Deschenes, 2004).
14.4.5 Otros factores
Se ha señalado que los leucocitos de las personas mayores liberan una mayor cantidad de IL-6 que los de las personas jóvenes (Rubenof, 1998). Esta elevación podría desempeñar también algún papel en la sarcopenia debido a los efectos catabólicos y anorexígenos desarrollados por esta citoquina. También el déficit de vitamina D puede intervenir en este proceso. El calcitriol actúa directamente sobre las células musculares estimulando la síntesis proteica y promoviendo la captación de fosfato, con lo que se generan moléculas de ATP, favoreciéndose la contractilidad muscular. La estimulación de los receptores específicos de la vitamina D (VDR) presentes en el músculo determina un aumento en la concentración de fibras de tipo II (Dawson-Hughes, 2005). Por otra parte, en diversos estudios se ha señalado la existencia de una relación entre el riesgo de caídas y los niveles de 25OHD, que disminuye significativamente al administrar suplementos de vitamina D (Bischoff-Ferrari, 2004; Dawson-Hughes et al., 2005; Venning, 2005).
13.5 Osteopatías metabólicas en el anciano
13.5.1 Introducción
Las osteopatías metabólicas no son sino la consecuencia de la alteración del fenómeno de la remodelación en alguno de sus aspectos. La osteoporosis, que es la entidad más frecuente, está determinada por el establecimiento de un balance negativo, a menudo acompañado de un aumento del turnover óseo, conceptos a los que ya nos hemos referido. Pero también pueden aparecer otras alteraciones en el proceso de la remodelación. Una de ellas es la falta de mineralización del osteoide, fenómeno definitorio de la osteomalacia, que en definitiva significa un fracaso del fenómeno de renovación del hueso. Si se debe a falta de vitamina D, como es lo más frecuente en los ancianos, aumenta secundariamente la PTH, por lo que cursa con un recambio elevado. Otro trastorno consiste en la formación, en lugar de hueso laminar normal, de hueso plexiforme, en que las fibras colágenas se disponen irregularmente y no se forman láminas, lo cual es también un fracaso de la renovación, porque el hueso plexiforme es más frágil que el laminar. La formación de hueso plexiforme parece verse favorecida por la existencia de un recambio exaltado, como ocurre en la enfermedad de Paget en el que el hueso resultante presentan una arquitectura anormal, con trabéculas orientadas de forma incorrecta, relacionadas entre sí de forma inadecuada, con grosor exagerado, etc. Por último, el mayor fracaso de la remodelación del hueso lo constituye aquella situación en que, tras haberse iniciado la remodelación con la destrucción del hueso, no llega a tener lugar la fase de formación. Es lo que sucede cuando hay una pérdida del acoplamiento. Ello no suele ocurrir de forma difusa en todo el organismo, sino de forma focal, en áreas bien delimitadas, lo que da lugar a la aparición de quistes, como en el caso de la osteitis fibrosa quística del hiperparatiroidismo, o de zonas líticas, como ocurre en el mieloma.
La mayor parte de las osteopatías metabólicas cursan con aumento de fragilidad del hueso y tendencia a las fracturas. El aumento de fragilidad guarda relación con los cambios que se producen en el hueso a consecuencia del trastorno en la remodelación: disminución generalizada de la masa ósea en la osteoporosis, disminución del tejido mineralizado en la osteomalacia, anormalidades en la arquitectura ósea en la enfermedad de Paget, acúmulo de hueso fibroso en la osteitis fibrosa quística, el Paget y las metástasis, pérdida focal de sustancia ósea en el mieloma y las metástasis líticas, etc. También suelen cursar con dolor, que puede guardar relación bien con la propia fractura, bien con el estímulo del periostio por la deformación del hueso, o bien con un aumento de la presión intramedular. Las deformaciones constituyen la tercera manifestación en importancia y pueden deberse a fracturas mal consolidadas o a aumento de la deformabilidad del hueso (Olmos, 2004).
La descripción detallada de las distintas osteopatías metabólicas excede el objetivo de este capítulo. Sin embargo, teniendo en cuenta la elevada prevalencia de alguno de estos procesos –osteoporosis, hipovitaminosis D– entre los ancianos, hablaremos de los aspectos más relevantes de estas dos entidades.
13.5.2 Osteoporosis
La osteoporosis es una enfermedad esquelética sistémica caracterizada por una disminución de la masa ósea y una alteración de la microarquitectura del hueso, lo que conlleva una menor resistencia ósea con el consiguiente aumento de la susceptibilidad para el desarrollo de las fracturas (Figura 6).
Figura 6. Hueso normal (izquierda) y hueso osteoporótico (derecha) (autor desconocido).
Hasta hace unos años se tendía a reservar el diagnóstico de osteoporosis para aquellas situaciones en las que ya estaban presentes las fracturas. Sin embargo, un grupo de expertos de la OMS (WHO, 1994) propuso hace algunos años unos criterios diagnósticos basados en la determinación de la densidad mineral ósea. Las mujeres de raza blanca con valores de densidad ósea inferiores a la media juvenil en más de 2,5 desviaciones típicas (DT) (lo que suele rerpresentarse como “T < –2,5”) deben diagnosticarse de osteoporosis aunque no tengan fracturas, reservando el término de osteoporosis establecida o grave para aquellas situaciones en que también haya fracturas. Cuando la densidad ósea se encuentra entre –1 y – 2,5 DT, se habla de osteopenia.
13.5.2.1 Epidemiología de la osteoporosis
La osteoporosis, en su forma involutiva –con mucho las más frecuente–, es una enfermedad propia de las personas de edad avanzada que afecta especialmente a las mujeres y cuya prevalencia aumenta con la edad. Así, los estudios realizados en los Estados Unidos mostraron, en cifras aproximadas y mediante la determinación de la densidad ósea en las tres localizaciones típicas (muñeca, columna y cadera), una prevalencia para la década de los 50 a los 59 años, del 15%; para la de los 60-69 años, del 22%; para la de los 70-79 años, del 38%, y para la población de más de 80 años, del 70%. Las fracturas más frecuentes son las del tercio proximal del fémur (también denominadas fracturas de cadera), los aplastamientos vertebrales y la fractura del tercio distal del radio (fractura de Colles). En España, la tasa de fractura de cadera referida a la población mayor de 50 años, es de alrededor de 150-250 casos/100.000, siendo la relación mujer/hombre mayor de 2 (Olmos et al., 1992). Estas cifras son relativamente bajas si se comparan con las de los países nórdicos o anglosajones (300-1.000/100.000). La incidencia aumenta exponencialmente con la edad a partir de los 70-75 años y se calcula que 1 de cada 3 personas mayores de 80 años sufre o ha sufrido una fractura de cadera (Figura 7).
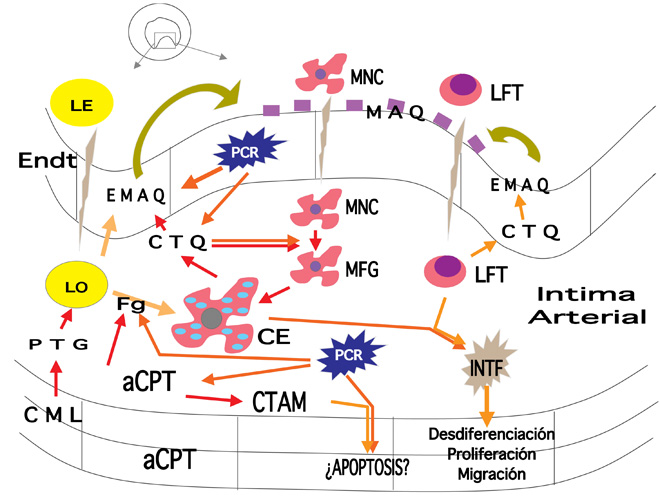
Figura 7. Variación con la edad en la tasa de fracturas de cadera observada en Cantabria en ambos sexos (elaboración de José Manuel Olmos Martínez, 1992).
La epidemiología de los aplastamientos vertebrales es menos conocida: aparecen fundamentalmente a partir de los 60-65 años y su prevalencia se sitúa en torno al 25% en los varones y al 40% en las mujeres mayores de esta edad. La fractura del tercio distal del radio (fractura de Colles) es también frecuente, aunque sus características epidemiológicas son algo distintas. Predomina en mujeres, pero la edad de inicio es más temprana (en torno a los 55 años) (González-Macías, 2004; Olmos, 2004).
13.5.2.2 Fisiopatología
El aspecto clínico fundamental de esta enfermedad consiste en la predisposición al desarrollo de fracturas. Las fracturas osteoporóticas son, por definición, patológicas, es decir, inapropiadas para el traumatismo que las provoca. En su desarrollo intervienen fundamentalmente dos factores: la fragilidad ósea y el traumatismo. La fragilidad, a su vez, guarda relación con la cantidad y la calidad del hueso. Cuanto menor sea la masa ósea, más frágil será el hueso.
La alteración de determinadas características del tejido óseo, como la perforación de las trabéculas, con la consiguiente pérdida de la conexión trabecular, o la acumulación de lesiones por fatiga por falta de renovación, facilitan el desarrollo de fracturas, y ayuda a explicar la diferente tendencia a las fracturas entre unas personas y otras. Ayuda también a ello la contribución al desarrollo de las fracturas de otros aspectos, como las características geométricas del hueso (excesiva longitud del cuello femoral). El otro factor determinante, el traumatismo, tiene especial interés en la fractura de cadera, ya que en la mayoría de los casos se produce tras una caída simple (es decir, desde un altura no superior a la que supone que el enfermo se encuentre con los pies a la altura del suelo). Por otra parte, los ancianos tienden a caerse más que los jóvenes, debido al deterioro de sus funciones neurológicas y motoras (disminución de la agudeza visual y de los reflejos posturales) y suelen tener una disminución en el grosor de las partes blandas. En los colapsos vertebrales el traumatismo no es relevante. En muchos casos pueden desencadenarse tras un pequeño esfuerzo (levantar peso, agacharse), pero otras veces no se reconoce factor desencadenante alguno.
13.5.2.3 Tratamiento
Además del tratamiento específico de cada tipo de fractura, conviene aplicar una serie de medidas generales a todos los pacientes osteoporóticos. El ejercicio físico debe aconsejarse dentro de las limitaciones que imponga el estado del paciente. Pasear durante 30-60 minutos 3-4 veces a la semana podría ser suficiente. También son útiles los ejercicios dirigidos a tonificar la musculatura de la espalda. La ingesta de calcio debe ser de 1-1,5 g/día, bien a expensas de productos lácteos o bien mediante la administración de sales de calcio. La litiasis renal o la hipercalciuria contraindican su uso, pudiéndose administrar en estos casos una tiazida, que retiene calcio en el túbulo renal. También deben cubrirse los requerimientos mínimos de vitamina D (~ 800 UI/día), dado que, como ya hemos referido, con frecuencia los pacientes de edad son deficientes en vitamina D. En este sentido conviene mencionar que existen diversos ensayos clínicos aleatorizados en los que se ha valorado la eficacia del tratamiento con suplementos de vitamina D sobre la incidencia de fracturas osteoporóticas en los ancianos. El más conocido y de muestra más numerosa fue realizado en Francia (Chapuy, 1992) en el que se demostró que la administración de 1.200 gr de calcio y 800 UI de vitamina D al día, reducían la incidencia de fractura de cadera en ancianas que vivían en residencias. Posteriormente (Lips et al., 1996) no pudieron confirmar estos resultados en ancianos holandeses de ambos sexos que vivían en su domicilio. Estudios poblacionales realizados en Finlandia (Heikinheimo, 1992) y Boston (Dawson-Hughes et al., 1997) observaron que la administración de 700-800 UI/día de vitamina D3, o la inyección intramuscular anual de 150,000-300,000 IU de ergocalciferol, respectivamente, reducían las fracturas de cadera entre un 25-50%. Finalmente, en fechas recientes se han publicado tres ensayos clínicos realizados en el Reino Unido con resultados discordantes. En uno de ellos se comprobó cómo la administración de 100.000 UI cada cuatro meses, reducía significativamente la tasa de fracturas de cadera en ancianos que vivían en casa (Trivedi, 2003), mientras que en otros dos no se observaron cambios tras la administración de 800 UI diarias de vitamina D (Porthouse, 2005; RECORD, 2005). Estas discrepancias podrían guardar relación con las distintas dosis de vitamina D administradas, la adherencia al tratamiento y la dotación en vitamina D de las personas incluidas en los ensayos. Este último aspecto estaría a su vez en relación con el grado de exposición al sol (menor en ancianos institucionalizados), la latitud o la existencia de alimentos fortificados (Dawson-Hughes, 2005). Para intentar aclarar estos aspectos, se realizó un meta-análisis (Bischoff-Ferrari et al., 2005) de los ensayos clínicos más relevantes, concluyendo que la administración de 700-800 UI de vitamina D al día reduce en alrededor de un 25% el riesgo de sufrir una fractura de cadera o una fractura no vertebral, tanto en los ancianos que viven en casa como en los que viven en una residencia. Sin embargo, dosis menores (400 UI/día) no parecen ser suficientes. Debe señalarse que este metanálisis no incluía los ensayos comentados más recientes (Porthouse, 2005; RECORD, 2005).
Además de las medidas generales que hemos comentado, el tratamiento de base de la osteoporosis consiste en la administración de fármacos que inhiben la resorción y, por lo tanto, disminuyen el recambio óseo (bisfosfonatos, estrógenos, raloxifeno, ranelato de estroncio y calcitonina). De hecho, en diversos ensayos clínicos publicados a lo largo de los 10 últimos años, se ha demostrado que estos fármacos son capaces de aumentar en proporciones variables la masa ósea, y de reducir entre un 30-50% el riesgo de fracturas. Los aminobisfosfonatos (alendronato [10 mg/d], risedronato [5mg/d]) y el ranelato de estroncio (2 g/d) disminuyen la incidencia de fracturas vertebrales y periféricas (incluida la fractura de cadera). El raloxifeno (60 mg/d) y la calcitonina (200 U/d por vía nasal) disminuyen la incidencia de fracturas vertebrales. Para el alendronato y el risedronato se dispone de preparados de administración semanal.
También se han observado resultados similares tras la administración intermitente de PTH subcutánea que, a diferencia de lo que ocurre cuando se administra en infusión continua, posee un efecto osteoinductor. El flúor, que también estimula la formación ósea, posee efectos controvertidos sobre las fracturas, por lo que debe considerarse como un fármaco experimental. Algo similar ocurre con otras sustancias con potencial utilidad terapéutica –vitamina K, estatinas, ipriflavona, GH, IGF-1, osteoprotegerina, etc.– (Olmos, 2004).
Aunque no existen unas normas universal y oficialmente establecidas, si parece poder aceptarse que el tratamiento de la osteoporosis debe individualizarse en función de la edad, el sexo, el riesgo de fractura y las características (efectos secundarios, comodidad de uso) de los fármacos a utilizar, además, lógicamente, de su eficacia.
El periodo de la vida en que más claramente justificado está el uso de fármacos antiosteoporóticos en los ancianos es el que va de los 65 a los 80 años. Los 65 marcan el momento en que aumenta la incidencia de fracturas osteoporóticas, mientras que los 80 constituyen un momento a partir del cual se dan dos factores que tienden a disminuir el riesgo de fractura en el resto de la vida del sujeto: una esperanza de vida corta y una menor contribución de la masa ósea al desarrollo de fractura. Aunque la tendencia a las caídas hace que el riesgo inmediato de fracturas (por ejemplo, durante el año siguiente) por encima de los 80 años sea alto, las circunstancias anteriores hacen que el beneficio que pueda esperarse del uso de fármacos antiosteoporóticos en esta época de la vida sea menor. En cambio sí cabe esperar efectos beneficiosos de la utilización de protectores de cadera y, obviamente, de la prevención de las caídas.
En cuanto al sexo, se dispone de muchas menos pruebas en relación a la eficacia de los fármacos en el tratamiento de la osteoporosis masculina que de la femenina, pero se considera que en ambos sexos pueden utilizarse los mismos preparados, con la lógica excepción de las hormonas sexuales. Las personas con fracturas previas o con masa ósea baja, tiene más riesgo de fractura, y por tanto se benefician más del tratamiento (González-Macías, 2005).
13.5.3 Hipovitaminosis D
La vitamina D3 o colecalciferol se sintetiza en la piel a partir del 7-dehidrocolesterol por la irradiación ultravioleta de longitud de onda entre 290 y 315 nm, que rompe el anillo B para formar pro-vitamina D3 que posteriormente se isomeriza a vitamina D3 (Figura 8).
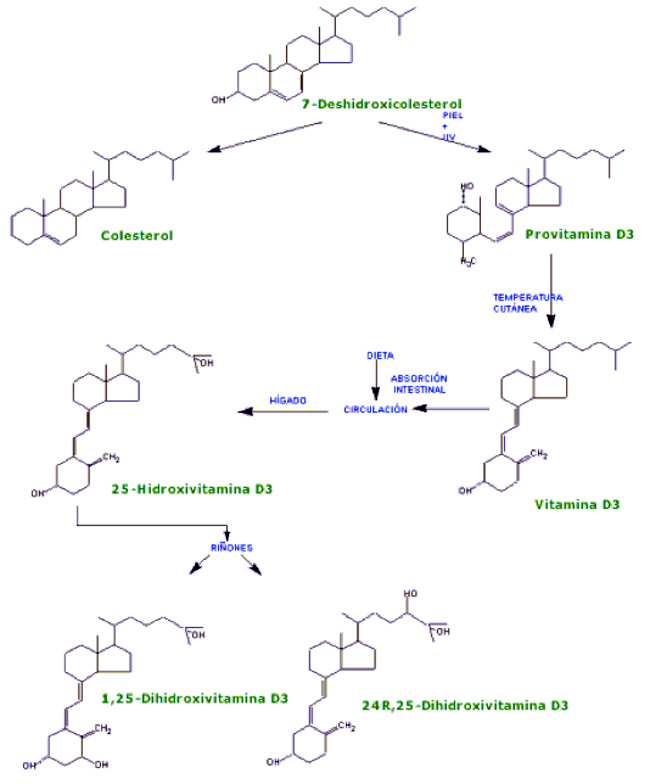
Figura 8. Metabolismo de la vitamina D (autor desconocido).
La vitamina D2 se produce artificialmente por irradiación del ergosterol, y puede utilizarse como suplemento vitamínico aunque su acción biológica es inferior a la de la vitamina D3. En el hígado, la vitamina D se metaboliza a 25(OH)D, que es el metabolito circulante más abundante, y tiene una larga vida media, considerándosela como índice del estado nutricional en vitamina D. Posteriormente sufre una nueva hidroxilación en las células tubulares del riñón por la acción de la 1a-hidroxilasa, transformándose en el 1,25(OH)2D3, también denominado calcitriol, que es el metabolito activo. El calcitriol favorece la absorción intestinal de calcio y promueve la diferenciación de los osteoblastos y la síntesis de colágeno, fosfatasa alcalina y osteocalcina por estas células. También estimula la formación y actividad de los osteoclastos, probablemente a través de su efecto sobre el sistema RANKL/OPG (Mundy et al., 2003). Estas acciones se llevan a cabo a través de su unión con receptores específicos (VDR) que están ampliamente distribuidos por el organismo, además de encontrarse en los clásicos órganos diana (intestino, hueso y riñón) (Quesada, 2004).
13.5.3.1 Epidemiología
La irradiación solar es la fuente principal de vitamina D, teniendo la dieta un papel secundario. Entre las fuentes exógenas más importantes de esta vitamina se encuentran los aceites de hígado de pescado, especialmente el de bacalao, y el pescado azul, así como la yema de huevo. La síntesis cutánea depende de factores como la latitud geográfica, las variaciones estacionales y atmosféricas, el grado de pigmentación y grosor de la piel, etc., (Holick, 1989). Hasta hace unos años, se hablaba de deficiencia de vitamina D cuando los niveles de 25(OH)D eran inferiores a 10 ng/ml, y de insuficiencia cuando se encontraban entre 10 y 20 ng/ml. Sin embargo, en la actualidad se considera que los niveles deseables de vitamina D estarían en torno a los 30 ng/ml, dado que es a partir de esta cifra cuando la administración exógena de vitamina D no consigue aumentar los niveles de 1,25(OH)2D ni reducir la concentración de PTH (Dawson-Hughes et al., 2005). Ya hemos comentado que la prevalencia de hipovitaminosis D es alta en la población general y especialmente entre los ancianos, siendo casi universal entre las personas que viven en residencias geriátricas (Mosekilde, 2005). Por ejemplo, en un estudio realizado en Dinamarca se comprobó que hasta el 80% de las personas mayores de 65 años presentaban una insuficiencia de vitamina D (25(OH)D < 20 ng/ml), que se acercaba al 100% en los ancianos institucionalizados. Por otra parte, en estos casos, más de la tercera parte presentaban una deficiencia grave de vitamina D (25(OH)D < 5 ng/ml) (Mosekilde, 2005). En el estudio SENECA, realizado en 12 países europeos, se analizó la exposición solar y la concentración sérica de vitamina D de las personas mayores. Un 13% sufría deficiencia (25(OH)D < 10 ng/ml) y alrededor del 60% insuficiencia (25(OH)D < 20 ng/ml). Además, en este estudio, los niveles más bajos de vitamina D se encontraron en los países mediterráneos –Grecia, Italia y España–. Las causas de estas diferencias entre las personas de edad se atribuyeron a la falta de fortificación de los alimentos con vitamina D, al tipo de ropa usada y a la actitud hacia la exposición solar en comparación con los países nórdicos (Torrijos, 2001). En EEUU la prevalencia de hipovitaminosis D es algo menor que en Europa, aunque tambiés es importante. Por ejemplo, recientemente se ha señalado que casi la tercera parte de las mujeres estadounidenses que siguen tratamiento para la osteoporosis presentan hipovitaminosis D (Holick et al., 2005). En España, más de la mitad de los ancianos, vivan en residencias o en casa, tienen niveles séricos de vitamina D claramente insuficientes (por debajo de 15 ng/ml), e incluso claramente deficientes (por debajo de 10 ng/ml), con un empeoramiento estacional al final del invierno y comienzo de la primavera (Quesada, 2004).
Las causas de este déficit en vitamina D son varias. En primer lugar, la dieta de los ancianos suele ser menos variada y tener un menor contenido en vitamina D. En segundo lugar, el grado de insolación suele ser menor, debido a los cambios en el estilo de vida, menor actividad física, dificultades en la deambulación y el uso de más ropa de abrigo que los adultos jóvenes. Pero además, la síntesis cutánea de vitamina D mediada por la irradiación ultravioleta disminuye en los ancianos. Por último, la producción renal de calcitriol también disminuye debido a la pérdida de función renal que acontece con la edad (Heaney, 1996; Mosekilde, 2005).
13.5.3.2 Fisiopatología
La falta de vitamina D puede tener repercusiones sobre el metabolismo óseo y sobre la actividad muscular. La falta de vitamina D provoca una disminución de la absorción intestinal de calcio, con la consiguiente hipocalcemia, que conduce a un aumento de la PTH (Lips, 2001). Ésta, al actuar sobre el hueso, consigue mantener la calcemia, aunque a expensas de una exaltación de los fenómenos de recambio óseo, que provoca a la larga un descenso de la masa ósea. Parfitt se ha referido a estos fenómenos denominándolos “primera fase de la osteopatía por hipovitaminosis D”, que en definitiva no sería sino una forma de osteoporosis de recambio alto (Parfitt, 1994). Cuando el déficit de vitamina D es más intenso (por debajo de los 10 ng/ml), se produce un trastorno en el proceso de mineralización, u osteomalacia (que en la terminología de Parfitt constituiría la fase avanzada de la osteopatía por hipovitaminosis D). No se sabe con exactitud si este trastorno guarda relación con la disminución de las concentraciones de calcio y fosfato o si, además, es debido a que la vitamina D ejerce un efecto directo sobre los osteoblastos. El osteoide se acumula, aumentando su grosor y cubriendo la superficie de la mayoría de las trabéculas (Figura 9).
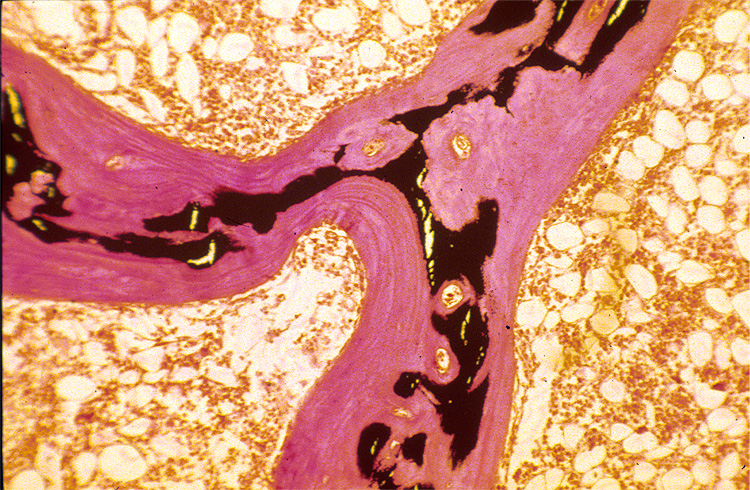
Figura 9. Imagen microscópica de la tinción de Von Kossa en una muestra de biopsia ósea de un paciente con osteomalacia. El hueso mineralizado (negro) ha sido sustituido casi por completo por osteoide (rosa) (autor desconocido).
La sustitución del hueso mineralizado por hueso sin mineralizar hace que disminuya su resistencia y dureza, facilitándose la aparición de deformidades y fracturas. Por otra parte, la misma deformabilidad es probablemente la causa, al estimular los receptores óseos del periostio distendido, de que la sobrecarga mecánica produzca dolor, que suele ser sordo y difuso, más intenso en las caderas y la columna lumbar. Las fracturas pueden ser completas (cuello de fémur) o incompletas, también denominadas seudofracturas o líneas de Looser-Milkman. Las de cuello de fémur probablemente son más frecuentes en los pacientes que han pasado mucho tiempo en la primera fase de la osteopatía por hipovitaminosis D, o fase osteopenizante de la carencia vitamínica. Las seudofracturas serían más propias del déficit de mineralización, o fase avanzada de la osteopatía por hipovitaminosis D u osteomalacia (Olmos, 2004).
La debilidad muscular, generalmente proximal, es también relativamente común en los pacientes con hipovitaminosis D. De hecho, en diversos estudios se ha observado que la falta de esta vitamina se acompaña de una disminución en la fuerza y resistencia muscular que revierte cuando se instaura tratamiento sustitutivo (Mosekilde, 2005, Venning, 2005). El efecto de la vitamina D sobre el músculo parece ser directo. Tras unirse a los VDR presentes en las células musculares, estimula la síntesis proteica y promueve la captación de fosfato generándose ATP, el cual desempeña un papel crucial en la contracción muscular. Además, los VDR intervienen en la distribución y regulación del calcio intracelular. Por otra parte, el hiperparatiroidismo secundario que acompaña al déficit de vitamina D podría también desempeñar algún papel. En estudios realizados con animales de experimentación se ha observado que la administración de PTH aumenta el catabolismo proteico y reduce la cantidad de ATP así como el número de fibras tipo 2 en el tejido muscular (Deschenes, 2004).
La debilidad muscular asociada a la hipovitamosis D podría contribuir a aumentar el riesgo de caídas y con ello la tasa de fracturas (Bischoff-Ferrari et al., 2004; Mosekilde, 2005; Venning, 2005). Así, en diversos estudios se ha comprobado que el riesgo de caídas entre los ancianos institucionalizados guarda relación con los niveles de vitamina D y con el grado de hiperparatiroidismo secundario (Venning, 2005). Al igual que sucedía con la prevención de las fracturas, parece que la vitamina D, cuando se administra en dosis suficientes (por encima de 700-800 UI/día), reduce también el riesgo de sufrir una caída. En un meta-análisis reciente se pudo comprobar que la suplementación con al menos 700-800 UI/ día de vitamina D reducía el riesgo de caídas en más de un 20% tanto en ancianos institucionalizados como en los que vivían en su domicilio, con independencia de que estuvieran recibiendo o no suplementos de calcio (Bishoff-Ferrari et al., 2005). Cabe por tanto la posibilidad de que parte del efecto beneficioso de la vitamina D sobre las fracturas, sea debido a las acciones de esta vitamina sobre el tejido muscular.
13.5.3.3 Tratamiento
El tratamiento de la hipovitaminosis D se basa, lógicamente en la administración de suplementos de vitamina D. La dosificación puede variar en función de la gravedad del proceso, de la causa que lo provoque y del preparado que utilicemos (vitamina D, 25(OH)D, 1,25(OH)2D). De cualquier modo, dada la alta prevalencia de hipovitaminosis D entre los ancianos, resulta razonable recomendar la administración de suplementos de vitamina D (800-1200 UI/día) a todas las personas mayores, especialmente si viven en residencias de ancianos.
Bibliografía
- Arnett A. Estructura y remodelado del hueso. En: Riancho J. A., González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid, Jarpyo Editores SA; 2004:1-6.
- Baron R. General principles of bone biology. En: Favus M. J. ed. Primer on the bone diseases and disorders of mineral metabolism. 5 ed. Washington. American Society for Bone and Mineral Research. 2003:1-8.
- Bischoff-Ferrari H. A., Dawson-Hughes B., Willett W. C., Staehelin H. B., Bazemore M. G., Zee R. Y., Wong J. B. Effect of vitamin D on falls. A meta-analysis. JAMA 2004;291; 1999-2006.
- Bischoff-Ferrari H. A., Willet W. C., Wong J. B., Giovanucci E., Dietrich T., Dawson-Hughes B. Fracture prevention with vitamin D supplementation. A meta-analysis of randomised controlled trials. JAMA 2005;293:2257-2264.
- Canalis E. Mechanisms of glucocorticoid-induced osteoporosis. Curr. Opin. Rheumatol. 2003;15:454-7.
- Chapuy M. C., Arlot M. E., Duboeuf F., Brun J., Crouzet B., Arnaud S., Delmas P. D., Meunier P. J. Vitamin D3 and calcium to prevent hip fractures in the elderly women. N. Engl. J. Med. 1992;327:1637-1642.
- Compston J. E. Vitamin D deficiency: time for action. BMJ 1998;317:1466-1467.
- Dawson-Hughes B., Harris S. S., Krall E. A., Dallal G. E. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N. Engl. J. Med. 1997;337:670-676.
- Dawson-Hughes B. The role of vitamin D in frature prevention. BoeKEy-Osteovision 2005;2:6-10 (a).
- Dawson-Hughes B., Heaney R. P., Holick M. F., Lips P., Meunier P. J., Vieth R. Estimates of optimal vitamin D status. Osteoporos. Int. (Publicado online: 18 Marzo 2005) (b).
- Delbonos O. Mollecular mechanism and therapeutic of the deficit on specific force in ageing skeletal muscle. Biogerontology 2002;3:265-270.
- Deschenes M. R. Effects of aging on muscle fibre type and size. Sports Med. 2004;34: 809-824.
- Dirks A. J., Leeuwenburgh C. The role of apoptosis in age related skeletal muscle atrophy. Sports Med. 2005;35:473-483.
- Doherty T. J. The influence of aging and sex on skeletal muscle mass and strength. Curr. Opin. Clin. Nutr. Metab. Care 2001;4:503-508.
- Erlich P. J., Lanyon L. E. Mechanical strain and bone cell function: a review. Osteoporos. Int. 2002;13:688-700.
- González Macías J. Osteoporosis primaria: epidemiología y diagnóstico. En: Riancho J. A. y González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid. Jarpyo Editores S. A. 2004;105-110.
- González Macías J., Olmos J. M. Introducción: fisiopatología del remodelado óseo. En: Nogués X ed. Formadores de hueso. Barcelona, Scientific Communication Management 2005:13-25.
- González Macías J., Hernández J. L., Olmos J. M. Risk factors for osteoporosis and osteoporotic fractures. Avd. Osteoporotic Fract. Manag. 2005;4:2-10.
- Grothos S., Chen S., Wang C. Y., Robey P. G., Shi S. Telomerase accelerates osteogenesis of bone marrow stromal cells by upregulation of the Cbfa1, osterix, and osteocalcin. J. Bone Miner. Res. 2000:18:716-727.
- Guillet C., Auguste P., Mayo W., Kreher P., Gascan H. Ciliary neurotrophic factor is a regulator of muscular stregth in aging. J. Neurosci. 1999;19:1257-1262.
- Gutierrez G. Regulación paracrina del hueso. En: Riancho J. A., González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid, Jarpyo Editores S. A.; 2004:13-18.
- Halloran B. P., Ferguson V. L., Simske S. J., Burghardt A., Venon L. L., Majumdar S. Changes in bone structure and mass with advancing age in male C57BL/6J mice. J. Bone Miner. Res. 2002;17:1044-1050.
- Hameed M., Harridge S. D., Goldspink G. Sarcopenia and hypertrophy: a role for insulin-growth factor I in aged muscle. Exerc. Sport Sci. Rev. 2002;30:15-19.
- Heaney R. P. Calcium, parathyroid function, bone, and aging. J. Clin. Endocrinol. Metab. 1996;81:1697-1698.
- Heikinheimo R. J., Inkovaara J. A., Harju E. J., Haavisto M. V., Kaarela R. H., Kataja J. M., et al. Annual injection of vitamin D and fractures of aged bones. Calcif. Tissue Int. 1992;51:105-10.
- Hofbauer L. C., Henfelder A. E. The role of receptor activator of nuclear factor k-B ligand and osteoprotegerin in the pathogenesis and treatment of metabolic bone diseases. J. Clin. Invest. 2000;85:2355-2363.
- Holick M. F., Matsuoka L. Y., Worstman J. Age, vitamin D, and solar ultraviolet radiation. Lancet 1989; 4:1104-1105.
- Holick M. F., Siris E. S., Binkley N., Beard M. K., Khan A., Katzer J. T., Petruschke R. A., Chen E., de Papp A. E. Prevalence of vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J. Clin. Endocrinol. Metab. 2005;90:3215-3224.
- Langlois J. A., Rosen C. J., Visser M., et al. Association between insulin-like growth factor I and bone mineral density in older women and men: the Framingham cohort study. J. Clin. Endocrinol. Metab. 1998;83:4257-4262.
- Lanyon L., Skerry T. Postmenopausal osteoporosis as a failure of bone’s adaptation to functional loading: a hypothesis. J. Bone Miner. Res. 2001;16:1937-1947.
- Lips P., Graafmans W. C., Ooms M. E., Bezemer P. D., Bouter L. M. Vitamin D supplementation and fracture incidence in elderly persons: a randomised, placebo-controlled clinical trial. Ann. Intern. Med. 1996;124 400-406.
- Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocrine Rev. 2001;22:477-501.
- Manolagas S. C. Birth and death of bone cells: basic and regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocrine Rev. 2000; 21:115-137.
- McKane W. R., Khosla S., Egan K. S., Robins S. P., Burritt M. F., Riggs B. L. Role of calcium intake in modulating age-related increases in parathyroid function and bone resorption. J. Clin. Endocrinol. Metab. 1996;81:1699-1703.
- Mezquita P., Muñoz M. Alonso A. Otras hormonas: hormonas tiroideas, GH, glucocorticoides. En: Riancho J. A. y González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid. Jarpyo Editores S. A. 2004;45-48.
- Mosekilde L. Vitamin D and the elderly. Clin. Endocrinol. 2005;62:265-281.
- Mundy G. R., Chen D., Oyajobi D. O. Bone remodelling. En: Favus M. J. ed. Primer on the bone diseases and disorders of mineral metabolism. 5 ed. Washington. American Society for Bone and Mineral Research. 2003:46-58.
- Munuera L., Martínez M. E., Delgado A. Fisiopatología del hueso del anciano. En: Ferrández L. ed. Fracturas en el anciano. Madrid, EGRAF SA; 2001:23-34.
- Olmos J. M. Martínez J., García J., Matorras P., Moreno J. J. González Macías J. Incidencia de fractura de cadera en Cantabria. Med. Clin. (Barc.) 1992;99:729-731.
- Olmos J. M. Osteopatías metabólicas. En: Rodés J., Guardia J., eds. Medicina Interna. Barcelona, Masson SA; 2004:2704-2723.
- Ophoff J., Vanderschueren D. The senile osteoporosis mouse model SAMP-6: the ideal animal model for human osteoporosis? BoneKey–Osteovision, 2005;2:26-34.
- Parfitt A. M. Osteomalacia and related disorders. En: Avioli L. V., Krane S. M., eds. Metabolic Bone Disease (2 ed.). San Diego. Academic Press; 1994:329-396.
- Porthouse J., Cockayne S., King C., et al. Randomised controlled trial of calcium and supplementation with cholecalciferol (vitamin D3) for prevention of fractures in primary care. BMJ 2005;330:1003-1010.
- Quesada J. M. ed. 25-Hidroxivitamina D y osteoporosis. Barcelona. Trajecte SA 1998.
- Quesada J. M. Vitamina D. En: Riancho J. A. y González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid. Jarpyo Editores SA 2004;29-33.
- Raisz L. W., Seeman E. Causes of age-related bone loss and bone fragility: an alterantive view. J. Bone Miner. Res. 2001;16:1948-1952.
- RECORD trial group. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamina D, RECORD): a randomised placebo-controlled trial. Lancet 2005;365:1621-1628.
- Riancho J. A., Zarrabeitia M. T., Amado J. A., Olmos J. M., González Macías J. Age-related differences in cytokine secretion. Gerontology 1994;40:8-12.
- Riancho J. A. Hormonas sexuales. En: Riancho J. A. y González Macías J. eds. Manual práctico de osteoporosis y enfermedades del metabolismo mineral. Madrid. Jarpyo Editores S. A. 2004;42-44.
- Rosen C. J., Kiel D. P. Age-related osteoporosis. En: Favus M. J. ed. Primer on the bone diseases and disorders of mineral metabolism. 5 ed. Washington. American Society for Bone and Mineral Research. 2003:89-92.
- Rubenof R., Harris T. B., Abad L. W., et al. Monocyte cytokine production in elderly population: effect of age and inflammation. J. Gerontol. 1998;53:M20-M26.
- Seeman E. Periosteal bone formation-a neglected determinant of bone strength. N. Engl. J. Med. 2003;349:320-3.
- Trivedi D. P., Doll R., Khaw K. T. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ 2003;326:469-472.
- Torrijos A. Calcio y vitamina D. En: Díaz Curiel M. ed. Actualización de osteoporosis. Madrid. FHOEMO. 2001;93-102.
- Venning G. Recent developments in vitamin D deficiency and muscle weakness among elderly people. BMJ 2005;330:524-526.
- WHO. World Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO. Technical Report Series. Ginebra, Suiza. 1994.