Tema 4. Regulación de la osmolaridad y del volumen de los líquidos corporales
4.1 Reabsorción de sodio y agua
El sodio y sus sales representan alrededor del 90% de los solutos osmóticamente activos del medio interno y participan mayoritariamente en la osmolalidad y volumen de éste. De su proceso de reabsorción depende la de gran parte de solutos por el transporte acoplado o la difusión, aprovechando gradientes electroquímicos favorables generados por el sodio.
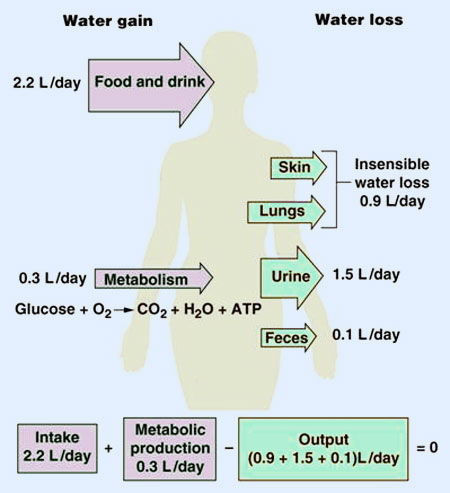
Las variaciones que afectan al sodio repercuten en el volumen del líquido extracelular (LEC), originando complejos mecanismos de respuesta para el restablecimiento de los valores fisiológicos. Todas las sales de sodio circulantes se filtran a nivel glomerular. De ellos, se reabsorben el 96-99%. Dependiendo de la ingesta de sodio, son excretados entre 150 y 1.000 mEq diarios que coinciden con lo aportado por la dieta. Este equilibrio permite mantener un valor promedio para el sodio, en el medio interno de 145 mEq/L.
El transporte activo de sodio hacia el espacio intersticial es la causa de que:
- a) Se origine un desplazamiento de agua por vía paracelular.
- b) Se produzca una entrada pasiva de Na desde la luz al interior celular.
- c) Tenga lugar un desplazamiento acoplado de otros iones, especialmente el cloro.
- d) Se acople el desplazamiento de otras sustancias, aprovechado el gradiente de sodio, para su incorporación a la célula tubular por cotransporte, o desde ésta a la zona tubular, por antitransporte.
La ATPasa Na/K está presente en las membranas basolaterales de la nefrona, a excepción de la rama estrecha del asa de Henle; por consiguiente, el sodio puede ser reabsorbido activamente en todos estos puntos.
4.1.1 Reabsorción de sodio y agua en el túbulo contorneado proximal y asa de Henle
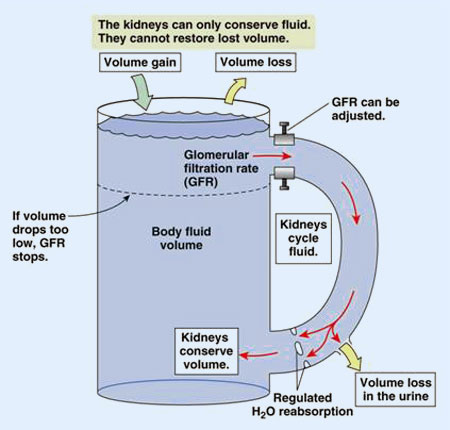
La reabsorción de sodio en el túbulo contorneado proximal supone un 65% de la carga filtrada, y un 27% más en la rama ascendente del asa de Henle. La rama descendente del asa de Henle es permeable al agua, mientras que la ascendente resulta impermeable. La rama ascendente gruesa utiliza de nuevo la ATPasa Na/K para la reabsorcion activa de Na, el resultado es una notable reabsorción de solutos no compensada por una reabsorción de agua y, en consecuencia, la dilución del filtrado. Al túbulo contorneado distal llega un contenido de volumen reducido (80%) y una concentración hipoosmolar (100-150 mOsm/Kg).
© Pearson Education, Inc., publishing as Benjamin Cummings, 2007.
4.1.2 Reabsorción de sodio y agua en el túbulo contorneado distal y colector
En este tramo de la nefrona, se produce la reabsorción variable de agua y sodio. En su reabsorción juega un papel importante la aldosterona, especialmente en el túbulo colector. Concentraciones plasmáticas elevadas de aldosterona promueven la reabsorción, prácticamente total, del sodio contenido en el túbulo, mientras que una disminución favorecería una natriuresis (eliminación urinaria de sodio) que, en caso de ausencia absoluta de hormona, alcanzaría a la totalidad del sodio que ingresa en el tubo colector.
Cuando la permeabilidad es grande, es decir, en presencia de ADH, la reabsorción de solutos en el túbulo colector cortical se ve acompañada por el desplazamiento de agua, con lo que el contenido tubular se vuelve isoosmótico. En esta situación, y manteniéndose la permeabilidad en el tramo medular del túbulo colector, la hipertonía de la médula favorecería el desplazamiento de agua hasta el equilibrio de concentraciones (1200 mOsm/Kg). Cuando la permeabilidad está reducida, el filtrado hipotónico que discurre por el túbulo distal y el colector se introduce en la médula sin que tenga lugar reabsorción de agua, por lo que llegará a la papila con un elevado grado de dilución.
4.2 Regulación de la reabsorción de sodio y agua
Las modificaciones que afectan a la excreción de sodio tienen una repercusión inmediata en la osmolaridad y el volumen del líquido extracelular.
Si se considera un volumen de líquido extracelular de 14 litros, la adición de 1,6 g de ClNa (2 mEq/L), que supone un aporte de sodio de algo más del 1% de su concentración fisiológica, provocaría un aumento en la osmolalidad total de 4 mOsm/Kg y la necesidad de aumentar el volumen en 0,2 litros para restablecer la concentración fisiológica. Esta circunstancia desencadena la puesta en marcha de los mecanismos que controlan la sed y la diuresis, con el fin de mantener los valores adecuados.
Desde un punto de vista general, los mecanismos que regulan el volumen y la concentración del medio interno son:
- a) Los barorreceptores. Que detectan modificaciones de presión hidrostática en el aparato circulatorio.
- b) Los osmorreceptores. Que son capaces de detectar modificaciones en la concentración del medio.
Las respuestas pueden corresponder a modificaciones hemodinámicas, de la circulación renal y modificaciones en el transporte de sodio y agua, propiciados por factores muy diversos. Entre estos factores los más importantes son:
- a) Dispositivos de autorregulación renal.
- b) Acción directa de hormonas sobre la permeabilidad de determinados segmentos tubulares.
- c) Efecto simpático directo sobre el transporte de sodio.
4.2.1 Modificaciones en el transporte de sodio y agua
Cuando las necesidades de control se extienden a largo plazo, existen mecanismos de mayor entidad que el control de la velocidad de filtración y que afectan directamente al transporte de sodio y agua.
4.2.1.1 Mecanismos relacionados con el equilibrio glomerulo-tubular
El mantenimiento de una tasa de reabsorción relativamente constante en el tramo proximal tiene como efecto más relevante amortiguar las variaciones de la TFG para que el flujo, que circula por las porciones distales de la nefrona, se mantenga dentro de límites habituales y así garantizar la precisión de los mecanismos de regulación homeostática de solutos y agua que actúan a ese nivel.
4.2.1.2 Acción de la aldosterona
La aldosterona actúa directamente sobre las células principales de los túbulos distales y colectores, promoviendo la reabsorción de sodio, de la que es responsable en una proporción del 2% del total recuperado.
© Pearson Education, Inc., publishing as Benjamin Cummings, 2007.
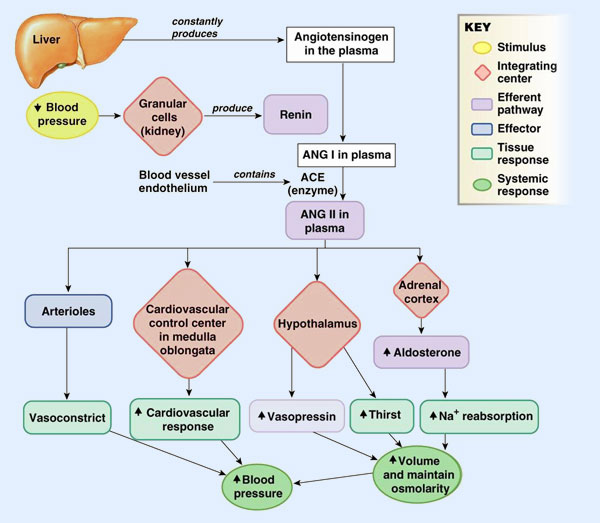
La renina se sintetiza en el aparato yuxtaglomerular, estimulada por:
- a) Modificaciones de la presión arterial.
- b) Alteraciones del flujo tubular que accede a la porción distal de la nefrona, con efecto estimulante sobre la mácula densa.
- c) Aumento de la actividad simpática renal, e inhibida por la acción de la propia angiotensina, que ejerce un efecto de retroalimentación.
La actividad promotora de angiotensina II, a cargo de la renina, se realiza catalizando, en el hígado, el desdoblamiento del péptido angiotensinógeno en antiogensina I. Posteriormente, una enzima convertidota (ECA), que se localiza preferentemente en los capilares pulmonares, transforma la angiotensina I en angiotensina II. Por último, la angiotensina II actúa directamente sobre las células glomerulosas de las suprarrenales, aumentando la producción de aldosterona.
A pesar del efecto sobre la reabsorción de sodio, la aldosterona tiene una importancia relativa en el control de su concentración plasmática. La razón es que, al aumentar la cantidad de sodio reabsorbida, aumenta paralelamente la de agua y el volumen de líquido extracelular resulta incrementado.
4.2.1.3 Efecto de la ADH y mecanismo de la sed
Constituye uno de los mecanismos más eficaces en el control de la osmolaridad del medio interno. El control de la ADH se realiza en el hipotálamo, donde se localizan osmorreceptores que son estimulados por un aumento de la concentración de sodio y, a su vez, inducen la síntesis de ADH en la hipófisis posterior. La ADH ejerce su acción sobre los túbulos renales aumentando la reabsorción de agua.
En la misma zona hipotalámica se localizan una serie de áreas que, convenientemente estimuladas, provocan el deseo de beber. Cuando la osmolalidad del medio interno supera en 4 mOsm/kg a la fisiológica (umbral de bebida), se dispara el mecanismo de la sed. El mecanismo conjunto ADH-sed constituye el sistema más importante de control de la concentración y el volumen del líquido extracelular.
4.3 Mecanismos de concentración del asa de Henle
La creación de un ambiente medular muy hipertónico, favorecido por la ADH, implica una máxima capacidad para concentrar orina y soportar una pérdida hídrica mínima. Si el intersticio medular resulta poco concentrado, también será menor la concentración máxima que pueda alcanzar la orina y, en consecuencia, el volumen de agua perdido por diuresis será mayor. Esta estrategia permite mantener un equilibrio hídrico satisfactorio, incluso en condiciones extremas. Por ejemplo, ciertos roedores del desierto logran concentraciones de orina de hasta 5000 mOsm/kg, lo que permite una eficacia tal en la reabsorción de agua que basta para suplir sus necesidades con la que se produce por vía metabólica, con lo que la ingesta es prácticamente nula.
Los organismos necesitan una mínima cantidad de agua para la eliminación diaria obligada de solutos, principalmente productos de desecho e iones sobrantes tras el ajuste homeostático, que en el hombre alcanza, por término medio 700 mOsm aunque esta cifra está sujeta a múltiples variaciones, en función del estado metabólico, ingesta, etc. Si la máxima concentración del intersticio medular es de 1.200 mOsm/kg, como se ha dicho antes, quiere decir que el volumen mínimo de agua, en el que irán disueltos los 700 mOsm de soluto, es de medio litro (700 mOsm/1.200 mOsm/kg = 0,583 L). Es decir, la pérdida obligatoria diaria de agua es de 0,583 litros, y si no son aportados se produciría una inevitable deshidratación.
Para lograr el ambiente hipertónico medular que posibilite la concentración de orina, participa un conjunto funcional medular constituido por el asa de Henle, el túbulo colector y los vasa recta. Estos ponen en funcionamiento coordinado dos mecanismos:
4.3.1 Efecto multiplicador a contracorriente
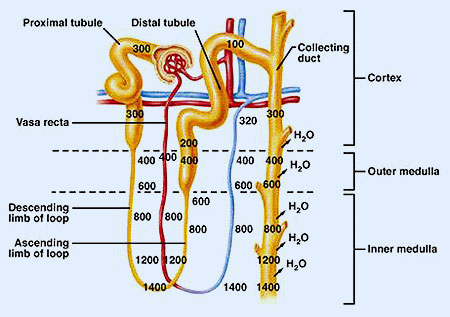
Es el mecanismo que causa el ambiente hipertónico medular, a expensas de ClNa procedente de la reabsorción activa en la rama ascendente del asa de Henle y de urea difundida desde los túbulos colectores. Este mecanismo es desarrollado por las nefronas yuxtamedulares cuyas asas se internan en la médula, hasta los extremos de las papilas.
El mecanismo se basa en el hecho de que la rama descendente del asa es muy permeable al agua. Por el contrario, la rama ascendente es impermeable al agua y permeable al ClNa y la urea (esta última en menor proporción), desarrollando, además, en su tramo grueso, una intensa reabsorción activa de ClNa. En esta situación, la extracción activa de cloruro sódico permite mantener un gradiente de 200 mOsm/kg con el intersticio. Por su parte, la rama descendente perderá agua para restablecer el equilibrio con el intersticio.
Este modelo sirve para explicar la creación de un gradiente corticomedular con hipertonía en las zonas más profundas y el papel que desempeñan los vasa recta de la circulación medular en el mantenimiento del gradiente de concentración.
Analizando la composición del medio intersticial se puede observar que la concentración máxima de las zonas más profundas se logra a expensas de un 50% de urea y un 50% de ClNa. La urea procede del túbulo colector, del que difunde pasivamente al concentrarse en su interior a medida que se produce la reabsorción de agua inducida por ADH.
4.3.2 Mecanismo de intercambio a contracorriente
Si la circulación que acompaña al asa de Henle a través de la médula fuera la ordinaria, se eliminaría en poco tiempo el gradiente de concentración establecido. En su lugar, la circulación la desarrollan vasos largos y rectos que disponen de ramas descendentes y ascendentes, las cuales se unen en su extremo final (región papilar), formando una horquilla.
Los vasa recta son muy permeables al agua y solutos, estableciendo un mecanismo de intercambio a contracorriente, de manera que acceden a la médula con una concentración plasmática isotónica y, a medida que se internan en ella, se produce una difusión de solutos hacia su interior y de agua al exterior, equilibrando la concentración con el intersticio que le rodea. En la rama ascendente el proceso se invierte: se absorbe agua y difunden solutos hacia la médula, disponiendo de una concentración ligeramente superior a la inicial cuando retornan a la región cortical. Así, el intercambio a contracorriente producido evita que se disipe el gradiente de concentración logrado para la médula.
4.4 Diuresis
El organismo necesita eliminar diariamente una cantidad determinada de solutos, que varía según la situación metabólica y la ingesta, cifrándose en unos 700 mOsm por día. La excreción de solutos requiere un volumen de agua tal que la concentración sea equivalente a la máxima que pueda lograrse en la médula renal. Esa mínima cantidad de agua, que se había calculado en poco más de medio litro, constituye la diuresis diaria obligada.
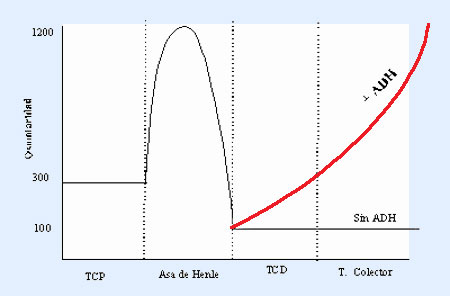
En una situación normal, la excreción de un volumen mayor obedece a la necesidad de mantener una concentración fisiológica para el medio interno y está en relación con la ingesta de agua y solutos. La hormona ADH es la encargada de regular la diuresis final que soportará diariamente el organismo (entre un mínimo de 0,6 L/día en orinas de máxima concentración (1.200 mOsm/kg) hasta un máximo de 20 L/día, en las de máxima dilución (50 mOsm/kg).
4.4.1 Eliminación de orina concentrada
En presencia de ADH, la reabsorción de solutos en el túbulo colector se ve acompañada de un desplazamiento osmótico de agua, reduciendo el volumen de filtrado que discurre por el túbulo e incrementando la concentración de solutos no reabsorbidos. La intensidad con la que el agua es reabsorbida depende de la concentración medular, puesto que la acción de ADH es aumentar la permeabilidad de los túbulos colectores, y en consecuencia es el gradiente de concentración entre la luz y el intersticio el que establece la cantidad. La urea difundida hacia la médula colabora en la instauración del medio hipertónico, que en estas condiciones adquiere el valor más elevado (1.200 mOsm/kg), y la diuresis será escasa y con una concentración igual a la medular.
4.4.2 Eliminación de orina diluida
Cuando la ADH está ausente, la permeabilidad en los túbulos colectores disminuye drásticamente y, en consecuencia, la recuperación de solutos no se acompaña de reabsorción de agua; esto sucede en situación de exceso de agua. La eliminación del exceso de agua se logra recuperando mayor cantidad de solutos que de agua, lo que provoca un contenido tubular diluido.
4.4.3 Aclaramiento osmolar y aclaramiento de agua libre
Se puede aplicar la fórmula del aclaramiento para calcular el volumen de plasma (por minuto) depurado de sustancias osmóticamente activas, según la expresión:
Cosm = Osmoles eliminados en orina por minuto/Osmolalidad plasmática
Esta expresión indica la cantidad de agua necesaria para eliminar la carga de solutos en una orina isotónica con el plasma. Si se resta al volumen de orina por minuto el valor del aclaramiento osmolar, se obtiene el aclaramiento de agua libre, o exceso de agua eliminado, por encima de la que sería necesaria para excretar una orina isotónica. Si tiene un valor positivo, el organismo elimina orina hipotónica y en consecuencia pierde agua. Si el aclaramiento de agua libre es un valor negativo, la orina es hipertónica y el organismo recupera agua.
4.5 Regulación del ión potasio
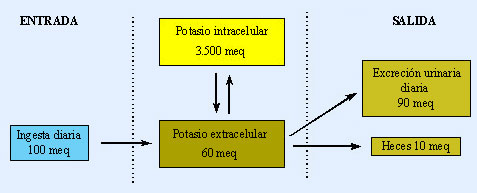
El potasio se distribuye en el organismo principalmente en el medio intracelular. Su concentración plasmática es de 4 mEq/L, mientras que en el interior celular alcanza unos 150 mEq/L, lo que supone un 98% del potasio total.
La importancia del mantenimiento de su equilibrio radica en que contribuye de forma esencial a la excitabilidad celular participando, junto con el sodio, en las respuestas eléctricas de la membrana celular.
La elevación de la concentración extracelular de potasio produce el aumento de la excitabilidad celular por disminución del potencial de reposo. Su descenso tendría un efecto contrario, es decir, elevaría dicho potencial al provocar una hiperpolarización, con lo que la excitabilidad se vería reducida. Por encima de 5,5 mEq/l extracelular de potasio, el aumento de excitabilidad podría causar un ataque cardíaco, mientras que por debajo de 3,5mEq/l, podrían producirse arritmias por falta de excitabilidad.
El equilibrio del potasio en el organismo es el resultado, por una parte, de la relación entrada-salida (ingesta-excreción) y por otra, del reparto que se establezca entre el interior y el exterior celular. El control del primero de los factores es responsabilidad de la excreción renal, que se encarga de acoplar la eliminación de potasio a la cantidad ingerida.
4.5.1 Equilibrio interno: regulación de la relación intra-extracelular
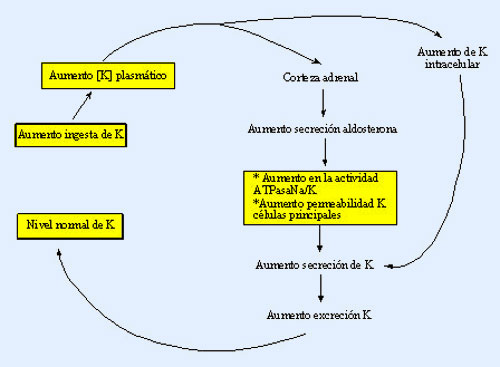
Diversos factores contribuyen a alterar la concentración de K dentro y fuera de la célula. Puesto que su concentración extracelular es tan pequeña, variaciones mínimas tienen un efecto directo que provoca alteraciones notables de la concentración de potasio extracelular. Un aumento de K extracelular estimularía la producción de insulina, adrenalina y aldosterona favoreciendo la entrada de potasio en las células hepáticas, el tejido óseo, el músculo esquelético y los eritrocitos.
La variación de pH afecta al K del interior y exterior celular. Un incremento de hidrogeniones en el medio extracelular da lugar a la salida de iones K de la célula, intercambiándose con H que entran. En situación de alcalosis el proceso se invierte, es decir, se incorporan iones K al interior celular.
4.5.2 Equilibrio externo: excreción renal de K'
En condiciones normales de funcionamiento, el riñón excreta diariamente alrededor de un 15% de la carga filtrada de potasio, cantidad equivalente a la ingesta diaria. Cuando la concentración de potasio plasmático se eleva, a causa del aporte dietético, o por razones endógenas (acidosis o descenso en la concentración de hormonas participantes en su homeostasis), la cantidad excretada se eleva, alcanzando proporciones superiores al 150%, lo que pone de manifiesto la capacidad tubular para secretar K. De igual manera, cuando el aporte de K es muy bajo, el porcentaje excretado puede reducirse a sólo un 1%. Los segmentos proximales y el asa de Henle reabsorben una cantidad relativamente constante, que representa algo más del 80% de la carga filtrada, correspondiendo a la porción final del túbulo distal y al colector la reabsorción o secreción, en función de la concentración plasmática.
En conjunto, al llegar al túbulo contorneado distal se ha reabsorbido alrededor del 85% del potasio filtrado, porcentaje que se mantiene con escasa variación, independiente de la ingesta. El control final del potasio excretado se ejerce especialmente en el túbulo colector cortical, mediante secreción o reabsorción facultativas que terminan por ajustar la concentración plasmática definitiva de potasio.
4.5.3 Regulación de la excreción de potasio
La excreción de potasio se ve influida por los siguientes factores:
- a) Concentración de K intersticial. El incremento de potasio en el medio intersticial, aunque escaso, puede resultar suficiente para estimular la actividad de la ATPasa Na'/K' basolateral.
- b) Concentración de Na en el líquido tubular. La concentración tubular aumentada de sodio aumenta la secreción de potasio.
- c) Acción de la aldosterona. Una concentración plasmática elevada, de potasio, tiene un efecto directo en la corteza suprarrenal, promoviendo la secreción de aldosterona. El mecanismo por el que esta hormona aumenta la excreción de potasio es el mismo por el que aumenta la reabsorción de sodio.
- d) Efecto del pH.
4.6 Regulación de Ca++, Mg++, fosfatos y urea
Además de Na, K y Cl, otros iones requieren una homeostasis que asegure su presencia plasmática estable. Los riñones, en situaciones normales, excretan cantidades equivalentes a la aportada por la dieta y ante aumentos o disminuciones se actúa sobre la absorción intestinal y reabsorción tubular para obtener la adecuada regularización de sus concentraciones plasmáticas.
4.6.1 Regulación de la excreción de calcio
El proceso de filtración renal incorpora al túbulo el 60% del calcio total, no asociado a proteínas, del que es recuperado alrededor del 99%. En el túbulo proximal se reabsorbe el 60% y en el asa de Henle un 20% de la carga inicial, un 15% se obtiene del túbulo contorneado distal y el resto, alrededor del 4%, en el túbulo colector.
El control de la excreción lo ejerce fundamentalmente la parathormona (PTH), que produce un aumento de la reabsorción en las porciones distases de la nefrona.
4.6.2 Regulación de la excreción de magnesio
El ion magnesio se encuentra en el plasma a una concentración de 1,8 mEq/L. Se encuentra asociado en un 20% a proteínas plasmáticas, por lo que resulta filtrado un 80% del total.
En estado normal, la excreción viene ajustada al aporte de magnesio por la dieta, recuperándose alrededor del 97% del filtrado inicialmente. Hasta el túbulo distal, es reabsorbido un 95% de la carga filtrada mediante difusión pasiva, especialmente en la rama ascendente del asa de Henle, donde se recupera más del 60%. En las porciones más distales de la nefrona se reabsorbe una pequeña cantidad, alrededor de un 2%.
4.6.3 Regulación de la excreción de fosfato
La mayor reabsorción se produce en el túbulo proximal (65%), por vía transcelular, cotransportado con el sodio. En el asa de Henle tiene lugar la recuperación de un 12% y en las porciones distal y túbulo colector se recupera alrededor de un 3%.
En su regulación participa también la parathormona, que actúa inhibiendo la reabsorción en el túbulo proximal, a la vez que favorece la movilización de fosfato óseo, con lo que el efecto es de una considerable eliminación por la orina.
4.6.4 Regulación de la excreción de urea
La urea es el mayor producto final del metabolismo proteico y el mayor soluto urinario en condiciones normales. Se filtra libremente en cantidades de 900 mmol/día y su reabsorción es pasiva dependiendo del gradiente de concentración y de la velocidad del flujo tubular, aproximadamente el 50% es reabsorbido a nivel del túbulo proximal. La ADH aumenta la permeabilidad de los túbulos colectores pudiendo reabsorberse hasta el 70%. Colabora en la generación de la hipertonicidad de la médula renal y su concentración aumenta por el mecanismo de contracorriente, ya que es reciclada entre el túbulo colector y el asa de Henle.