Tema 5. Regulación del equilibrio ácido-base
5.1 Introducción
La concentración de iones H+ libres en sangre se mantiene normalmente entre 40 y 45 nmol/litro, lo cual da un valor de pH sanguíneo comprendido entre 7,35 y 7,45, valor medio de referencia 7,40 (los valores compatibles con la vida estarían entre 6,8 y 7,7). El organismo produce continuamente ácidos no volátiles y CO2 como consecuencia del metabolismo, estas moléculas generadoras de H+ modificarán la concentración de estos iones y el valor del pH. La regulación se realiza en dos etapas:
- Los iones H+ son amortiguados o neutralizados por otras moléculas.
- Posteriormente son eliminados del organismo.
El equilibrio ácido-base estudia los mecanismos que mantienen los valores de los iones hidrógeno de los líquidos corporales dentro de los límites normales. Las células son muy sensibles al pH del medio extracelular. Éste tiene un pH de 7,4 y un descenso por debajo de 7 o un ascenso por encima de 7,8 puede resultar letal. Ello significa que la concentración de H+ debe encontrarse entre 16-100 nmol/litro. La sangre es ligeramente alcalina con un pH de 7,4±0,04, es decir con un rango en la concentración de H+ aún menor.
5.2 pH intracelular
Las células son menos alcalinas que el plasma, con un pH próximo a 7. Existen en el interior celular una gran cantidad de funciones que son dependientes estrechamente del pH (glucolisis, gluconeogénesis, síntesis de ADN, proliferación celular, funcionamiento de canales, etc.).
El metabolismo celular produce H+ que deben ser tamponados antes de proceder a su excreción. Las proteínas celulares y otras macromoléculas ejercen un importante papel tamponador y el sistema antitransporte de Na+ / H+ la vía más importante para su eliminación de las células.
El pH extracelular es un reflejo del pH intracelular y a la viceversa. La concentración de H+ en el cuerpo se regula de forma muy exacta, ya que las proteínas intracelulares como enzimas y canales de membrana son muy sensibles al pH.
5.3 Disociación del agua
El agua es un electrolito débil, que se disocia en pequeña escala:
H2O → H+ + OH–
En esta reacción la constante de equilibrio K valdrá:
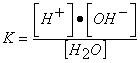
Como esta constante es muy pequeña, la relación puede escribirse:
![]() ,
,
siendo el primer término prácticamente constante, denominado "producto iónico del agua" (Kw), y su valor depende de la temperatura.
|
0ºC |
10–14,9 |
|
8ºC |
10–14,1 |
|
24ºC |
10–14,0 |
Si se toma como valor de referencia los 24ºC y el producto de iones es de 10–14,0 cada litro de agua pura contiene 10–7 equivalentes de hidrogeniones o de iones hidroxilo.
Toda solución electrolítica con estos mismos valores se dice que es neutra. Si la concentración de hidrogeniones es mayor de 10–7 es ácida y con valores inferiores es básica.
La neutralidad ácido-base viene dada por la igualdad de concentraciones de iones hidrógeno e iones hidroxilo; y la neutralidad electrolítica viene dada por la igualdad de aniones y cationes.
5.4 Concepto de pH
Se define pH como el logaritmo decimal del inverso de la [H+] expresada en equivalentes–gr/litro (N)
pH = log 1 / [H+] o
pH = –log [H+]
De esta forma la neutralidad viene indicada por un valor de pH = 7 siendo los valores inferiores de estado ácido y los valores superiores de estado básico.
De la misma manera se puede definir:
pOH = log 1 / [OH–]
Así:
pH + pOH = 14
5.4.1 Fisicoquímica del equilibrio ácido-base
Un ácido es un compuesto capaz de liberar H+
AH Æ A– + H+
Una base es un compuesto capaz de aceptar H+
B + H+ Æ BH+
Los pares ácido-básicos o papares conjugados están formados por un ácido y su base conjugada.
Ácido Æ Base + H+
Los ácidos y bases pueden caracterizarse en función de su disociación como ácidos y bases fuertes o débiles. En el caso de los fuertes la disociación es casi total y en el caso de los débiles la disociación es parcial.
En el caso de un ácido débil la reacción que tendrá lugar estará desplazada hacia la izquierda cuanto más débil sea el ácido, y por lo tanto menos se disocie:
AH Æ A– + H+
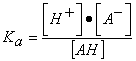 ; despejando [H+];
; despejando [H+];
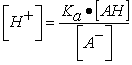 ; tomando logaritmos quedaría:
; tomando logaritmos quedaría:
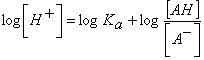 ; cambiando de signo ambos lados de la ecuación,
; cambiando de signo ambos lados de la ecuación,
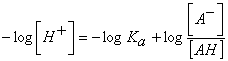 ; que puede escribirse como:
; que puede escribirse como:
![]() ; ecuación denominada de Henderson-Hasselbach.
; ecuación denominada de Henderson-Hasselbach.
5.4.2 Disoluciones reguladoras, amortiguadoras o tampón
Los valores de pH en el organismo deben mantenerse en márgenes muy estrechos y próximos a la neutralidad, variando ligeramente según el órgano, célula o compartimento intracelular analizado. La sangre arterial presenta un pH alrededor de 7,4 y las oscilaciones, compatibles con la vida, no pueden ir más allá de cuatro décimas hacia arriba o hacia abajo. Para conseguirlo, el cuerpo humano dispone de varios sistemas, siendo el eje central de los mismos las disoluciones reguladoras o amortiguadoras.
Se define una disolución de este tipo a la que es capaz de disminuir o "amortiguar" las variaciones de pH en el medio en el que se encuentra.
H+ + Tampón– Æ Tampón
Estas disoluciones pueden estar formadas de la siguiente manera:
- a) Un ácido débil y la sal de su base conjugada. Ejemplo: ácido acético/acetato sódico.
- b) Una base débil y la sal de su ácido conjugado. Ejemplo: amoniaco/cloruro amónico.
Al añadir a estas disoluciones ácidos y/o bases se produce un cambio mínimo en el pH, su capacidad amortiguadora se mide como la cantidad de ácido o base añadida para lograr un cambio de una unidad en el pH.
La ley de masas aplicada a la situación en el equilibrio de una disolución amortiguadora permite la medida del pH mediante la ecuación de Henderson-Hasselbach.
La capacidad amortiguadora es máxima cuando el pH a regular está próximo a los valores de pKa. Los tampones más importantes son los siguientes:
![]()
- Tampón Carbónico/Bicarbonato: H+ + HCO–3 Æ H 2CO3 Æ CO2 + H2O
- Tampón Fosfato : H+ + HPO2-4 Æ H2 PO4–
- Tampón Proteinato: H+ + Protein2– Æ HProtein (n–1)–

Los amortiguadores o tampones constituyen la primera línea de defensa en la regulación del pH.
5.4.3 Estimación del pH plasmático
La ecuación de Henderson-Hasselbach puede ser aplicada a los tampones, principalmente al Carbónico/Bicarbonato. El pKa de la siguiente reacción es de 6,1 y la solubilidad del CO2 es de 0,03 mmol/mm. Hg.
CO2 + H2O Æ H2CO3 Æ H+ + HCO–3 ;
abreviadamente: CO2 + H2O Æ H+ + HCO–3
pH = 6,1 + log [HCO–3] / 0,03 p CO2
Si la concentración de ión bicarbonato vale 24 mmol/litro y la presión parcial de anhídrido carbónico en sangre arterial es de 40 mm Hg. Llevados estos valores a la ecuación anterior se obtiene un pH de 7,40. Esta ecuación resume la regulación fisiológica del pH, el numerador es controlado por el riñón, mientras que el denominador es controlado por el aparato respiratorio.
Además esta ecuación también permite una clasificación racional de los desequilibrios ácido-básicos. El numerador se ve afectado bien por ingestión o producción de ácidos o bases produciendo acidosis o alcalosis metabólicas. El denominador se ve afectado por alteraciones en la ventilación pulmonar, o en la composición del aire inspirado dando lugar a acidosis o alcalosis respiratorias.
En algunas ocasiones las alteraciones pueden venir dadas por los dos mecanismos. De forma resumida se pueden clasificar las alteraciones ácido-básicas en:
- Disminución de bicarbonato: acidosis metabólica.
- Aumento de bicarbonato: alcalosis metabólica.
- Disminución de anhídrido carbónico: alcalosis respiratoria.
- Aumento de anhídrido carbónico: acidosis respiratoria.
5.4.4 Regeneración de los tampones corporales a nivel renal
La ventilación es la segunda línea de defensa en el control del pH. Es una respuesta rápida y de control reflejo que puede solucionar el 75% de los trastornos de pH. La línea final de defensa está en los riñones; son más lentos que los otros dos sistemas, amortiguadores y ventilación, pero muy eficaces para manejar cualquier trastorno remanente del pH en condiciones normales. Los riñones son los encargados de rectificar los cambios producidos por un exceso de ácido o álcali en el organismo. Debido a la compensación respiratoria, el pH puede encontrarse dentro de la normalidad, sin embargo, la concentración de tampones puede encontrarse disminuida (si ha habido un exceso de ácidos) o aumentada (si el exceso es de álcali) y se requiere su vuelta a los niveles normales.
El riñón, en caso de acidosis por ejemplo, repone el bicarbonato que ha sido consumido y permite la excreción de hidrogeniones en la orina.
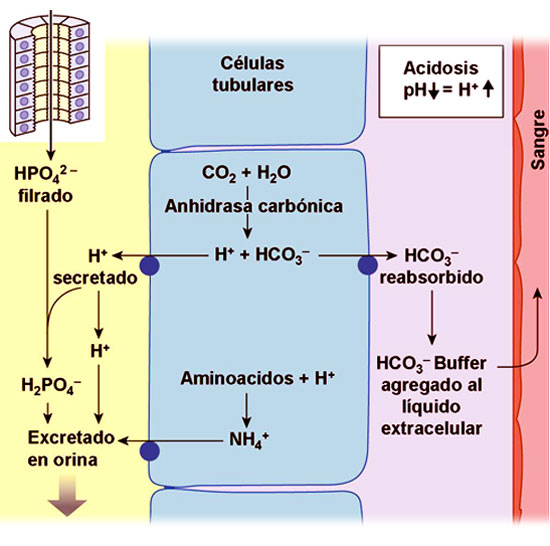
Los mecanismos de los que dispone son los siguientes:
- De forma directa, excretando o reabsorbiendo H+.
- De forma indirecta, aumentando o disminuyendo la reabsorción de bicarbonato.
Para llevar a cabo estas funciones se dispone de distintos mecanismos de transporte:
- a) Contratransportador bidireccional de Na+–H+ , mueve Na+ hacia el interior celular y H+ hacia la luz del túbulo.
- b) Cotransportador basolateral de Na+–HCO3– mueve ambos hacia el líquido intersticial.
- c) La H+–ATPasa mueve H+ en contra de su gradiente hacia la luz tubular.
- d) La H+–K+ –ATPasa, reabsorbe K+ y secreta H+.
- e) Contratransportador bidireccional de Na+ –NH4+ , mueve NH4+ a la luz tubular y Na+ al interior.